Les anmies
DÕaprs une confrence du Pr. Agr. Bertrand Arnulf
(Immuno-hmatologie - Hpital Saint Louis)
Sance du 7 avril 2011
1. Gnralits
1.1. Dfinition
Une
anmie est dfinie par la baisse du taux de
lÕhmoglobine du sang circulant par
rapport des valeurs normales obtenues partir dÕun chantillon le plus large
possible de sujets sains et en tenant compte du sexe et de lÕge. Paralllement
cette baisse, on observe le plus souvent un abaissement du nombre de globules
rouges ainsi que de lÕhmatocrite.
Une anmie est dfinie par un taux dÕhmoglobine
circulante infrieur :
-
13
g/dl pour un homme
-
12
g/dl pour une femme ou un enfant
-
11
g/dl pour un enfant de moins dÕun an
-
14
g/dl pour un nouveau-n
-
10,5
g/dl pour une femme enceinte au 3me trimestre de sa
grossesse
1.2. Epidmiologie
LÕanmie est le problme hmatologique le plus frquent en griatrie. Les chiffres de prvalence suivants peuvent tre proposs pour les sujets gs de plus de 70 ans : 10 15 % des sujets ambulatoires, 25 % des institutionnaliss, 40 50 % des hospitaliss sont anmiques.
Elle est due pour un tiers une carence fer ou une carence en vitamine B12 et folates dans environ 10% des cas. Dans 44% des cas elle est en relation avec une insuffisance rnale, un syndrome inflammatoire ou une noplasie. Plus rarement, on retrouve une mylodysplasie ou un mylome. Dans un tiers de cas, lÕanmie demeure inexplique.
1.3. Les examens de base
1.3.1. LÕhmogramme
LÕhmatocrite
Il
reprsente les volumes relatifs du plasma et des globules rouges. Les valeurs
normales chez homme sont comprises entre 40 et 54% et chez la femme entre 35 et
47%.
La
rticulocytose
Elle sert apprcier l'tat de la production rythrocytaire
de la moelle osseuse et permet d'aboutir au caractre central ou priphrique
de l'anmie.
-
Rgnratif :
rticulocytes > 100 000 / mm3
priphrique
-
Argnratif :
rticulocytes < 100 000 / mm3 central.
Le
volume globulaire moyen (VGM)
Il rend compte de la taille des globules rouges (VGM =
Hmatocrite / Nombre de GR par mm3).
Le VGM est normalement compris entre 80 et 100 µm3 (fl).
-
VGM
> 100 µm3 macrocytaire.
-
VGM
< 80 µm3 microcytaire.
-
VGM
80 et 100 µm3 normocytaire
La
concentration corpusculaire moyenne en hmoglobine (CCMH)
CÕest la quantit d'hmoglobine contenue dans 100 ml
d'hmaties qui seraient dbarrasses du plasma (CCMH = Taux d'hmoglobine (g/100 ml) /
Hmatocrite x 100).
Cette concentration doit tre de 32 36 g/dl.
-
CCMH normale : anmie normochrome
-
CCMH
abaisse : anmie hypochrome.
La
teneur corpusculaire moyenne en hmoglobine (TCMH)
CÕest la quantit moyenne d'hmoglobine contenue dans un
globule rouge
(TCMH = Taux d'hmoglobine / Nombre de GR).
La
teneur se trouve normalement entre 27 et 31 picogrammes.
La
morphologie des hmaties
á
Anisocytose
: variation de la dimension
á
Poikilocytose
: variation de la forme (drpanocytose, ovalocytose, lliptocytose, microsphrocytose,
schizocytes, rouleaux
1.3.2. Les autres dosages
La ferritine reprsente la rserve en fer, la transferrine
ou sidrophiline est la protine transportant le fer. Deux paramtres sont
utiles : le coefficient de saturation de la transferrine (CST) et sa capacit
totale de fixation de la transferrine (CTF).
Fer srique + capacit totale de fixation de la transferrine
+ coefficient de saturation Ou
ferritinmie
Les
dosages de lÕacide folique rythrocytaire et celui de la Vitamine 12 apportent des informations
supplmentaires.
Un test
de Coombs ou un test l'antiglobuline permet la dtection des anticorps
incomplets grce l'action d'un srum htrologue anti-immunoglobulines qui
provoque l'agglutination et oriente ou non vers une anmie hmolytique
auto-immune.
1.4. Examens ventuels aprs le bilan initial
Selon les cas, une cascade dÕautres examens peut tre envisage au cas par cas
- Mylogramme ou biopsie mdullaire,
- Bilan thyrodien,
- Exploration digestive : fibroscopie gastrique ou coloscopie
1.5. Prsentation des anmies
Il faut apprcier degr d'urgence en fonction de la tolrance et de la cause. La tolrance dpend de lÕabondance et de la rapidit d'installation.
La symptomatologie est variable selon lÕintensit et lÕinstallation :
− Pleur, asthnie
− Polypne, tachycardie dÕeffort, puis mme au repos
− Cphales, vertiges, bourdonnements dÕoreille, mouches volantes
− Si anmie aigu, hypotension, voire collapsus
Les modes dÕadaptation lÕanmie sont de diffrentes natures
− Adaptation cardiovasculaire (rapide)
o Vasoconstriction priphrique
o Augmentation du dbit cardiaque
− Adaptation intra rythrocytaire (rapide)
o Diminution de lÕaffinit de lÕHb pour lÕoxygne,
o Meilleur relargage vers les tissus
o Adaptation trs rapide
− Augmentation de production mdullaire (plus lente) dpend de la cause
2. Hmatopose
2.2. En brefÉ
CÕest
la production quotidienne de
- 100
250 milliards de globules rouges dont la dure de vie est 120 jours
- 70
150 milliards de plaquettes, dont la dure de vie est 7 jours
- 50 milliards de
polynuclaires, dont la dure de vie est 24 heures

Les facteurs de croissance
hmatopotiques correspondent des
Ç hormones È de lÕhmatopose. On
distingue les facteurs agissant
−
De faon prcoce: Ç Stem
Cell Factor È, cytokines (interleukines)
o
Sur la diffrenciation terminale
(Ç Colony Stimulating Factor È) : M-CSF: Macrophage, GM-CSF:
Granulocyte/Macrophage, G-CSF: Granulocyte, rythropotine (EPO): globules
rouges et thrombopotine (TPO): plaquettes
−
Leur
point dÕimpact sur lÕhmatopose est rsum par le schma suivant :
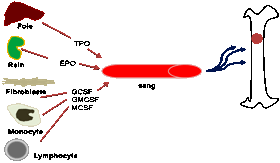
2.3. Rgulation de lÕrythropose
2.3.1. LÕrythropose
CÕest
l'ensemble des mcanismes qui concourent la formation des rythrocytes. Environ,
200 milliards dÕhmaties sont ainsi fabriques par jour, soit 2 millions par
seconde. Elle a pour finalit dÕassurer le maintien dÕun stock hmoglobinique
constant en produisant chaque instant un nombre de rticulocytes quivalent
au nombre d'hmaties phagocytes lors de l'hmolyse physiologique.
Physiologiquement,
la formation des rythrocytes est continue. En cas de besoin, les capacits d'adaptation
de l'rythropose sont trs importantes. En cas de pertes, la production
s'accrot; en cas de transfusions, la production diminue.
2.3.2. La cintique de lÕrythropose
Elle
dbute avec le passage en cycle de cellules souches quiescentes grce
l'intervention de facteurs de croissance. Les cellules souches rythrodes
proviennent de la CFU GEMM puis elles perdent les potentialits mgacaryocytaire
et granulocytaire pour devenir des cellules unipotentes, progniteurs engages
de faon irrversible vers la ligne rythrode : BFU E et CFU E.
Les
BFU E (burst forming unit-erythroid) sont les plus immatures. La prolifration
- diffrenciation des BFU E est galement sous la dpendance de l'Interleukine
3 et du GM CSF.
Les CFU-E (colony forming
unit-erythroid) sont plus matures. Elles donnent de petites colonies (< 50
cellules) aprs 7 jours de cultures. La prolifration - diffrenciation des CFU
E est sous la dpendance de l'rythropotine (EPO).
Les
BFU E aboutissent la formation terminale d'hmaties en 10 20 jours, les CFU
E en 5 8 jours.
Un
prorythroblaste, la suite de 4 mitoses, donne en moyenne 16 hmaties.
L'rythroblaste
acidophile qui expulse son noyau devient un rticulocyte. Le rticulocyte noform
reste 48 heures dans la moelle osseuse puis traverse les sinusodes
mdullaires, se retrouve dans le sang priphrique o il perd ses ribosomes en
moins de 48 heures pour devenir une hmatie mature.
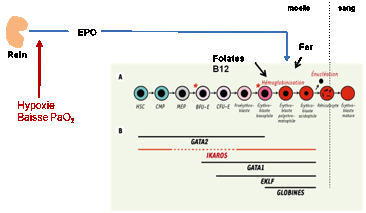
3. Classification des anmies
3.2. Les fausses anmies
Elles
sont le rsultat dÕune hmodilution dans lesquelles le nombre de GR est normal
mais il y a une expansion du volume plasmatique. Les principales tiologies
sont :
- La grossesse >
2me trimestre; Hb> 10.5 g/dl
- La splnomgalie
(volumineuse: hypersplnisme)
- Le syndrome des
macromolcules (Ig monoclonales; IgM)
3.3. Anmies microcytaires VGM<80 fl
3.3.1. Gnralits
Elles sont la consquence dÕun dfaut de synthse de
lÕhmoglobine. Trois grandes catgories sont distinguer. Les deux premires
sont assez souvent associes avec une tumeur digestive ou une maladie
inflammatoire TD
,
- La carence martiale : diminution du fer srique, augmentation
de la transferrine, et de la CTF, diminution forte de la ferritine
- Les syndromes inflammatoires : diminution du fer srique,
diminution de la tranferrine, et de la CTF, diminution de la ferritine
- Les hmoglobinopathies diagnostiques par lÕlectrophorse de lÕHb
(thalassmie α,b)
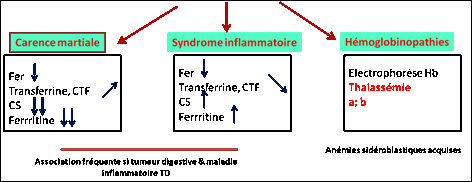
3.3.2. Anmies microcytaires par carence martiale
3.3.2.1. Mtabolisme du fer
Les pertes quotidiennes de fer sont de lÕordre dÕ1 mg. Les apports moyens sont de 10 25 mg dont 10% sont absorbs dans le duodnum et librs des protines alimentaires.
Le transport du fer est assur par une protine transporteuse, la sidrophiline (ou transferrine). La sidrophiline au ple sanguin de lÕentrocyte fixe 2 atomes de fer (duodnum). Le reste du fer est perdu dans les selles avec la desquamation.
Le fer circulant li la sidrophiline est dlivr pour rythropose et les rserves. SÕil y a beaucoup de fer dans lÕorganisme, la sidrophiline, qui transporte le fer est Ç sature È coefficient de saturation lev. SÕil y a peu de fer, la sidrophiline augmente et dlivre le plus vite possible le fer: elle donc peu sature coefficient de saturation bas
1 litre de sang= 500mg fer 3g de fer hmoglobinique au total
Plus de sidrophiline plus de capacit d'absorption leve dans les carences et les
besoins accrus
3.3.2.2. Les causes
Dans plus de 90% cas, cÕest une perte sanguine qui est en cause :
− Extrmement frquent: 10% des femmes (femme non mnopause origine gyncologique)
− Homme : cause digestive, le plus souvent saignement mconnu
− Les autres causes beaucoup plus rares
Les carences dÕapport sont plus rares : la malnutrition ou la malabsorption
3.3.2.3. Pour les plus de 65 ans
Une ferritinmie < 45microg/L une spcificit de
92% pour confirmer une carence martiale. Face cette situation, une fibro/coloscopie,
en lÕabsence dÕhmorrodes, identifie une cause dans 70 % des cas :
basse dans 20% des cas, haute dans 60% des cas et dans 16%, rien.
Attention, femme non mnopause, une fibro face
une Hb<10g/dl et/ou une ferritine<
20 µg/l.
Il faut savoir que les angiodysplasies ne sont pas dtectes
si Hb<10g/dl.
3.3.2.4. Traitement
Aprs avoir la cause+++, une substitution en fer : 100 200 mg par jour de fer ferreux pendant au moins 4 mois permet la restauration du stock de fer. La rparation se fait dans lÕordre suivant : lÕanmie, puis lÕhypochromie, puis la microcytose et enfin la ferritine
3.4. Anmies non microcytaires VGM>80 fl
3.4.1. Gnralits
LÕalgorithme de dcision passe par la mesure du taux
de rticulocytes. Selon les rsultats, lÕanmie est qualifie de
-
Rgnrative :
rticulocytes > 100 000 / mm3
priphrique
-
Argnrative :
rticulocytes < 100 000 / mm3 central.
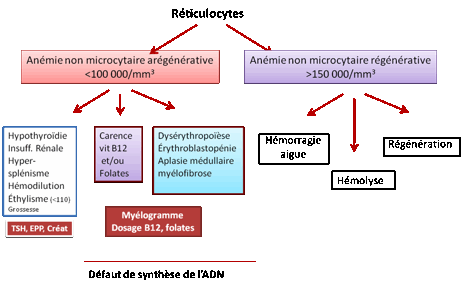
3.4.2. Origine centrale : insuffisance de production mdullaire
3.4.2.1. Contexte
Ce
sont des anmies argnratives;
les rticulocytes sont diminus, voire effondrs selon les cas. Elles peuvent
tre quantitatives ou qualitatives. Elles rvlent un trouble de la production
des GR, en raison de:
−
Diminution
de la synthse de lÕHb (carence en fer) ou de l'ADN (carence en folates ou en B12)
−
Diminution
de la synthse de lÕEPO (insuffisance rnale chronique, syndrome inflammatoire)
−
Atteintes
des progniteurs des GR, ou de la cellule souche : rythroblastopnie pure
(rare)
−
Augmentation
de la synthse dÕinhibiteurs (TNF) (syndrome inflammatoire)
−
Envahissement
mdullaire par une hmopathie maligne, un cancer ou une infection
−
Fibrose
mdullaire
−
Syndromes
mylodysplasiques
3.4.2.2. Les Carences en vit B12 et/ou en folates (Vit B9).
Les
carences en vitamine B12
Le mtabolisme
de la vitamine B12 passe par sa fixation dans lÕestomac au
facteur intrinsque (FI). Ce FI est secrt par les cellules paritales
gastriques. Le FI se fixe sur son rcepteur au niveau de lÕilon terminal et la
vit B12 est absorbe ce niveau. Elle est ensuite soit utilise (moelle
osseuse, cerveau), soit excrte au niveau rnal, soit stocke dans le foie.
La vitamine B12 est retrouve dans les protines animales (foie+++), fruits de mer et laitages.
Cliniquement, il existe un syndrome anmique. Et une atrophie des muqueuses digestives dans la maladie de Biermer. Celle-ci peut se compliquer dÕune atteinte neurologique (troubles de la sensibilit profonde, syndrome neuro-anmique, dmences possibles).
Le bilan retrouve une anmie macrocytaire argnrative, une carence en vit B12. Sur le mylogramme il existe une mgaloblastose en raison dÕune hmolyse intramdullaire.
Les principales
causes sont
−
Biermer+++, auto-immunit associe
(Thyrodite)
−
Gastrectomie (carences en 2 9 ans),
maladie cÏliaque, rsection de lÕilon terminal : carence en folates associe
Le traitement passe par une vitaminothrapie B12 en injection IM de 1000 gamma par mois vie dans la maladie de Biermer ou gastrectomies.
Les
carences en folates
Les folates sont absorbs dans le jjunum,
puis soit excrts par le rein, soit utiliss (systme nerveux, moelle
osseuseÉ), soit stocks dans le foie.
Ils sont retrouvs dans foie, lgumes verts, crales, fruits secsÉ
Cliniquement, il peut exister un syndrome
anmique dans un contexte vocateur.
Il existe une anmie macrocytaire argnrative et des folates rythrocytaires bas.
Les principales causes sont les carences dÕapport, les malabsorptions (atteinte jjunale ex : maladie de Crohn), les prolifrations bactriennes, les LNH, lÕalcoolisme notamment aigu. Enfin, certains mdicaments peuvent tre en cause : methotrexate, Bactrim, hydantones, antirtrovirauxÉ
Le traitement se
fait par une complmentation per os de folates.
3.4.2.3. Les mylodysplasies (SMD)
Il sÕagit dÕune insuffisance mdullaire
qualitative (Ç anmies rfractaires È)
Par dfaut de production de
cellules mylodes, commenant par la ligne rouge
Par mort intramdullaire par
anomalies qualitatives
LÕvolution se fait vers des cytopnies
ou la transformation en leucmie aigu.
On distingue
−
LÕanmie rfractaire simple
−
LÕanmie rfractaire avec excs de blastes (5-20% de myloblastes)
−
La leucmie mylomonocytaire
chronique
3.4.2.4. Anmie Ç inexplique È du sujet ag > 65 ans
Il sÕagit dÕun tableau dÕanmie modre > 10.5 g/dl, normocytaire, argnrative. La TSH est normale, la CL-Crat 30-90 et le frottis sanguin est normal. De plus la CRP, le fer et la vitamine B12 sont normaux.
Les explications avances actuellement sont :
− Rduction fonction endocrine rnale (rythropotine)
− Rduction scrtion andrognes (homme et femme) : baisse de 1g/dl dÕHb
− Drgulation production de cytokines inflammatoires (IL6, Hepcidine)
− Dfaut de capacit de prolifration des progniteurs hmatopotiques ?
− Mylodysplasie Ç prcoce È
Au-del de 85 ans la cause principale est lÕinsuffisance rnale +++++
3.4.3. Anmies non microcytaires rgnratives
3.4.3.1. Origine priphrique : raccourcissement de la dure de sjour des hmaties dans la circulation.
Ces
anmies sont rgnratives et la moelle est hyperproductive afin de compenser
la perte des globules rouges.
LÕanmie
est normocytaire (parfois discrtement macrocytaires), normochrome, rgnrative.
Les rticulocytes sont levs. Toutefois, un dlai de 2 3 jours est
ncessaire avant que les rticulocytes ne soient dverss dans la circulation.
Ces anmies relvent de 2 grandes entits :
−
Les
hmorragies
−
LÕhyperhmolyse
(pathologique). Celle-ci peut tre, intravasculaire : lÕhmolyse se fait dans
la circulation ou extravasculaire
LÕalgorithme
dcisionnel est rsum par le schma ci-dessous.
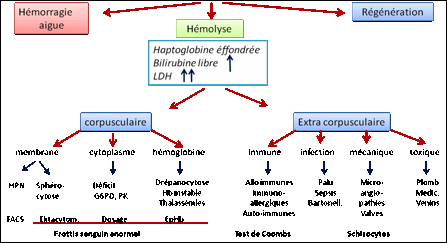
3.4.3.2. Les Anmies Hmolytiques
Le
contexte
Anmie due une lyse rythrocytaire acquise lie la prsence des auto-anticorps dirigs contre ses propres antignes. Dans ce cas, la destruction dpassant la capacit de rgnration mdullaire. Elles peuvent tre aigus ou chroniques. Leur installation est rapide. Elles se rencontrent dans 2 types de situations:
- Hmolyse extravasculaire, intratissulaire exagration du processus normal destruction par les macrophages, la rate, la moelle osseuse, le foie
- Hmolyse intravasculaire processus toujours anormal
La clinique oriente sur lÕorigine, ATCD, adnopathies, Infection, mdicamentsÉ
Le
bilan de base
Il comprend frottis sanguin et un test de
Coombs.
− Haptoglobinmie< 0.5 g/L inflammation, pathologie hpatique
− Rticulocytes >150 000/m3 Carence folates, B19 ou infiltration mdullaire
− Bilirubinmie libre augmente troubles glucuroconjuguaison
− LDH augmente Syndrome de lyseÉ..
Indication
de lÕlectrophorse de lÕhmoglobine
Microcytose avec ou sans anmie si fer srique normal
Hmolyse avec drpanocytes, cellules en cibles, grande hypochromie
Adulte sain : Hb A (α2/b2): 97 99 % ; Hb A2 (α2/δ2): 1 3.5 % ; Hb F (α2/γ2): traces
Prsence Hb anormale, S, C, E reprsente une anomalie qualitative par mutation. Elle est absente dans les thalassmies. Les formes A et S : htro A/S ; S sans A: S/S
Dans la bta thalassmie il existe une augmentation de HbA2 ou HbF. Dans lÕalpha thalassmie, lÕEpHb est normale.
Les principales causes
− DÕorigine corpusculaire
o Anomalie des enzymes: dficit en G6PD, PK
o Anomalie de lÕhmoglobine : synthse dÕun variant anormal de lÕHb (thalassmie, drpanocytose)
o Anomalie de la membrane (membranopathies) : elliptocytose, Minkowski-Chauffard
− DÕorigine extra-corpusculaire
o Toxique : saturnisme...
o Infectieuses : Clostridium Perfringens, paludismeÉ
o Mcanique : valve cardiaque mcanique (schizocytes)...
o Immunologiques : les plus frquentes (auto-immune - auto-anticorps, allo-immune - accident transfusion, MHNN, immuno-allergique
o Hmoglobinurie paroxystique nocturne (maladie de Marchiafava-Micheli)
o
Idiopathiques : les plus
frquentes
Dficit en glucose 6-phosphate dshydrognase
C'est l'enzymopathie la plus rpandue
qui affecte l'Afrique, la mditerrane, les spharades et l'Extrme-Orient. Elle
affecte le chromosome X et sa transmission est lie au sexe et affecte les
garons. Il existe de nombreux variants mutationnels de la G6PD (> 400), de
svrit variable.
Le mcanisme de lÕhmolyse est
sous-tendu par l'absence d'une enzyme cl de la glycolyse arobie (processus
dÕoxydorduction) mais son dficit ne suffit pas. La "crise" est dclenche
par lment extrieur (agression oxydante). Les agressions oxydantes
dclenchantes les plus frquentes sont:
- Les
mdicaments : antipaludens (Gd(-)A): primaquine, les sulfamides, les
quinolones, le CAF, le bleu de mthylne, l'urate oxydase, ...
- Certains
produits chimiques : nitrates, phnylhydrazine, naphtalne,
trinitrotolune
- Certains
vgtaux (Gd(-)B) : fves
- Des
infections (Gd(-)B) : microbiennes (pneumocoque,..), virales (hpatite,
MNI,..)
- Acidose
diabtique
Le diagnostic se fait l'occasion
- D'une grande
hmolyse aigu quelques heures jours aprsÉ
- Le noir
Gd(-)A, souvent la suite de la prise dÕun antipaluden (asthnie
brutale, subictre, douleurs abdominales, urines porto par
hmoglobinurie).
- Le
mditerranen Gd(-)B: Ç favisme È, aprs absorption fves,
inhalation pollen pendant floraison, ou aprs toute circonstance oxydante
(tableau svre dÕhmolyse aigu intravasculaire, douleurs abdominales ou
lombaires, malaise, fivre, urines porto, tat de choc ; parfois
CIVD/anurie)
- Une
hmolyse chronique
Maladie de Minkowski-Chauffard
CÕest une microsphrocytose, autosomale dominante et frquente. La microsphrocytose entrane une diminution de la dformabilit des hmaties et une destruction au niveau splnique. Le diagnostic est tabli en montrant une diminution de la rsistance osmotique.
Cliniquement, il existe un syndrome
anmique avec ictre, une splnomgalie.
Le traitement est la splnectomie.
La drpanocytose
CÕest une hmoglobinose S par mutation ponctuelle du codon 6 du gne de la b globine, par remplacement de lÕacide glutamique par de la valine. Cette mutation entrane
− Une polymrisation des chanes faible pression en O2
− Une dformation en faucille du GR risque de thrombose des petits vaisseaux
− Une hyperhmolyse
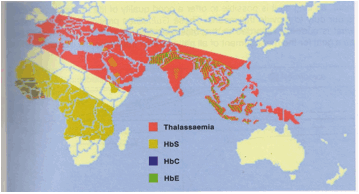
CÕest une maladie frquente. En effet, les formes htrozygotes, lÕallle est protecteur contre paludisme. Les zones gographiques comprennent lÕAfrique (Sngal, Benin, Cameroun), le bassin Mditerranen, lÕInde
Les formes htrozygotes (A/S) sont souvent asymptomatiques. Rarement des thromboses sont observes en cas de baisse profonde PaO2. SÕil existe une anmie franche, il faut rechercher dÕautres causes (S/C, S/beta thalassmieÉÉ)
Pour les formes homozygote (S/S), on observe des crises hmolytiques et des thromboses : infarctus splnique, osseux, intestinaux, une asplnie fonctionnelle associe des Infection +++ et des embolies graisseuses. Une microangiopathie (rtine, rein) et une cardiopathie peuvent coexister.
Le diagnostic est tabli par lÕlectrophorse de lÕhmoglobine et la dcouverte dÕune hmoglobine S.
Le traitement symptomatique :
hydratation, O2, transfusions, Hydraª, antibiotiques, antalgiquesÉ Trs rares
greffes de moelle.
Les cryoglobulinmies
Ce sont des anmies hmolytiques
auto-anticorps froids. Elles se prsentent sous forme de frquentes crises
intra-vasculaires, dclenches ou aggraves par lÕexposition au froid. Elles
peuvent tre :
- Secondaires
:
- Infections:
forme aigu, souvent brutale (IgM anti-I ou i) (Mycoplasma Pneumoniae,
listeria, miliaire tuberculeuse, viroses (MNI, CMV, rougeole, oreillons,
grippe,É)
- Hmopathies
lymphodes malignes : LLC, LMNH
- Hmoglobinurie
paroxystique a frigore:
hmolysine diphasique; froid: fixation; chaud: hmolyse brutale;
syphilis, virose.
- Idiopathique
:
- Maladie
des agglutinines froides de Dacie (vers 55 ans, hmolyse chronique +
pousses aigus dclenches par le froid. Titre lev dÕagglutinines
froides. Souvent IgM anti I. Parfois monoclonale, pic lectrophorse.)
4. Conclusion
Les anmies microcytaires VGM<80 fl Carence en fer, Inflammation, hmoglobulinopathie
Anmies non microcytaires rgnratives anomalie intrinsque ou non
Anmies non microcytaires non rgnrative causes centrales ou priphriques
− Dfaut de synthse de lÕADN
− Explorations digestives non contributives
− Trs souvent multifactorielles
− Circonstance de dcouvertes de pathologies bnignes et malignes
Analyse par tapes successivesÉ.