|
EPU95-Montmorency
Affections Respiratoires
& Maladies Allergiques
 Mise à jour du 24 Avril 2007 Mise à jour du 24 Avril 2007

Prise
en charge de l’Asthme de l’Adulte
Dr S. Salmeron
Chef de service
de Pneumologie - Hôpital Saint Joseph Paris
Séance du 4
septembre 2003
1. L’ASTHME : UN PROBLÈME DE SANTÉ
PUBLIQUE
La
prévalence de l’asthme en France s’est considérablement accrue depuis les
dernières décades.
Les
symptômes cliniques pris en compte et notés sur les questionnaires
permettent le diagnostic d’asthme sans avoir recours aux EFR (par exemple
toux nocturne et réveil la nuit avec sifflement)
La
prévalence cumulée (personnes ayant ou ayant eu des manifestations
d’asthme) est en France de :
4
8% de
la population générale correspondant à 5 Millions de sujets.
4
Pour
une population de jeunes comprise entre10 et 25 ans le pourcentage est de
10 à15 %.
4
La
prévalence actuelle (sujets ayant eu des manifestations lors des douze
derniers mois) est de 5%
4
Les
hospitalisations liées à l’asthme sont nombreuses
4
Le
nombre de décès liés à l’asthme est de 2 000 par an.
4
L’absentéisme
scolaire est en outre sous estimé
4
Les
dépenses globales de santé concernant l’asthme sont de 1,5 milliards
d’Euros en 2001 répartis :
o
2/3 en coûts directs è 60 % revient à la prise en charge
hospitalière
o
1/3 en
coûts indirects
L’âge
est un élément de gravité à prendre en compte. En vieillissant le
pourcentage d’asthmes légers diminue alors que celui des asthmes sévères
notamment cortico-dépendants augmente.
2. DÉFINITION DE L’ASTHME
2.1. Les différentes
définitions
La
définition ancienne ne donnait aucune idée de la physiopathologie :
« L’asthme est une maladie qui donne des accès de dyspnée
paroxystiques sifflantes régressant spontanément sans ou sous traitement
bronchodilatateurs. »
Lorsque
l’on a voulu introduire la notion d’inflammation, les experts
internationaux ont voulu que la définition tienne compte des aspects
physiopathologiques :
« L’asthme est une maladie inflammatoire chronique des bronches
(où toutes les cellules inflammatoires sont impliquées, mais où les éosinophiles
ont un rôle particulier) ».
2.2. Une définition, parmi
d’autres…
Il
se caractérise par une obstruction bronchique diffuse, variable,
réversible.
Pourquoi
diffuse ? Car il s’agit d’une affection qui touche l’ensemble de
l’arbre bronchique à la différence d’une obstruction localisée (tumeurs,
corps étrangers, …) qui peut aussi entraîner une dyspnée sifflante et même
parfois paroxystique). L’examen radiographique est nécessaire devant des
symptômes évocateurs d’asthme pour éviter une erreur diagnostique.
L’obstruction
dans l’asthme est liée à une hyper-réactivité bronchique.
L’asthme
se caractérise par des symptômes variables diversement associés : toux
(froid, nocturne, effort), sifflement (bronchite sifflante), oppression
thoracique (nocturne, dyspnée d’effort), expectoration. »
L’asthme
est sous diagnostiqué chez l’enfant et l’adulte malgré des symptômes
évocateurs.
3. LE ROLE DE L’INFLAMMATION DANS
L’ASTHME
Dans
la quasi-totalité des cas, c’est l’inflammation à l’intérieur des bronches
qui va déclencher les problèmes.
Une
bronche normale vue en coupe :
4
Est un
tuyau rond qui permet à l’air (O2) de pénétrer jusqu’aux alvéoles et d’en
ressortir lors de l’expiration
4
A sa
périphérie il existe un muscle qui, lorsqu’il se contracte, rétrécit le
diamètre de la bronche gênant le passage de l’air
Dans
l’asthme, quand la gêne respiratoire apparaît, le muscle se contracte et la
respiration devient difficile.
4
Cela
est connu depuis très longtemps.
4
La
prise d’un médicament ß 2 mimétique qui relâche le muscle entraîne une
amélioration rapide.
4
Si la
prise de ce médicament doit être répété par manque d’amélioration (2, 3
fois,… 6 fois si ce n’est 10), et si la gêne oblige le patient à s’asseoir,
le bronchospasme n’est pas seul en cause et l’inflammation est toujours
présente.
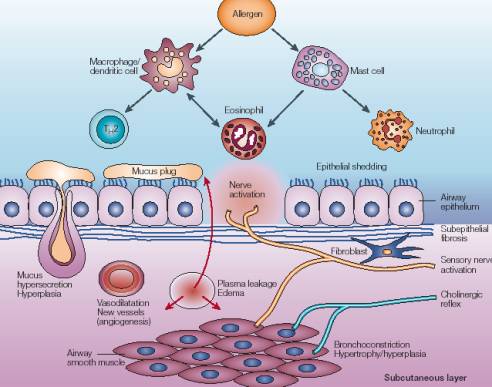
Une bronche inflammatoire a en coupe
un aspect différent d’une bronche normale
4
La
muqueuse est épaissie, rouge, liée à l’inflammation
4
L’inflammation
toujours présente dans l’asthme est capable d’exciter le muscle et
d’entraîner sa contraction.
Dans
ce cas, si on veut réduire la gêne liée à l’inflammation
qui
est initiale, il faut donner un anti-inflammatoire pour supprimer la cause
de la bronchoconstriction.
Dans
le système immunitaire extrêmement complexe, les cellules intelligentes
sont les lymphocytes. On sait actuellement que les lymphocytes peuvent
s’orienter dans deux directions en fonction de leur différenciation et
aboutir :
-
Soit à la cellule Th1 qui est une cellule
entrant dans le système de lutte
contre les infections,
-
Soit à la cellule Th2 qui vont déterminer dans le sang les réactions allergiques
(terrain atopique, …). L’excès de production de ces cellules Th2 dans la
paroi bronchique favorise la production de facteurs activant les
éosinophiles, et toutes ces cellules relarguent des médiateurs qui font
contracter les muscles bronchiques.
L’inflammation
est le mécanisme sous jacent de l’asthme et les corticoïdes sont les
molécules de base du traitement.
-
Dans
cette complexité de l’asthme, il existe des cellules productrices de leucotriènes.
Les leucotriènes sont directement proinflammatoires et directement
bronchoconstricteurs. Les corticoïdes s’opposent peu ou pas à l’action des
leucotriènes.
-
Sur le
plan pratique, les corticoïdes
inhalés sont nettement prioritaires, et l’utilisation d’un
anti-leucotriènes (per os) peut y être associé en cas de nécessité.
Pour
aborder la prise en charge d’un asthmatique, il faut être imprégné de cette
notion d’inflammation dans l’asthme afin de pouvoir correctement expliquer
au patient ce qu’il a, le pourquoi et le comment du traitement.
Cette
éducation doit être progressive, pas à pas lors de chaque consultation et
fonction de la situation pour que son attention soit attirée par des
symptômes qui, pour lui et son entourage, peuvent passer comme insignifiants.
Le patient doit prendre conscience
que son asthme est une maladie inflammatoire chronique des bronches à ne pas négliger.
4. PIEGES AU DIAGNOSTIC
4.1. Deux situations
Si
le diagnostic d’asthme est facile dans les cas typiques, deux situations
doivent rendre prudent le clinicien puisqu’il s’agit d’une constatation
toujours actuelle :
La
situation la plus fréquente est la non reconnaissance de
l’asthme et cela quel que soit l’âge du patient (aussi bien chez
l’enfant que chez l’adulte).
-
Soit
que les symptômes soient minimisés
par le patient et/ou l’entourage,
-
Soit
que le ou les symptômes soient
insuffisamment étudiés ou recherchés par le clinicien, de même que le
terrain sur lequel il survient, pour pouvoir évoquer cliniquement le
diagnostic d’asthme et le confirmer par des épreuves fonctionnelles
respiratoires (EFR).
La
situation la plus triste est celle du diagnostic par
excès. Le diagnostic est posé sans avoir préalablement éliminé une
cause locale et en particulier un cancer. Le problème est ici celui de la
radio du thorax : soit absence d’une radiographie initiale, soit
mauvaise interprétation.
4.2. Trois cas cliniques
comme exemples
1° cas
Un
patient de 36 ans, suivi depuis 15 ans, prenait des médicaments mais de
façon très périodiques. Aux questions :
-
« vous
n’avez pas d’asthme ?», il répondait « non,non, c’est de
l’allergie sans plus »
-
« pas
de sifflement ?», « non, sauf 2 ou 3 fois la nuit »
-
« il
y a une gêne respiratoire ? », « non, sauf une fois au
collège et une autre fois à la campagne et là heureusement que j’avais de
la Ventoline™, parce que ça n’allait pas bien »
-
« est-ce
qu’il existe une toux à l’effort ? », « oui, mais seulement
lorsque j’ai couru »
-
« est-ce
qu’il y a un traitement de fond ? », « non je n’ai pas de
traitement de fond ».
Le
père est asthmatique très grave, la mère est allergique. Ce patient d’un
milieu social élevé ne se reconnaît pas comme asthmatique.
2° cas
Pour
montrer qu’il n’y a pas d’âge pour vérifier qu’il y a bien une radio
pulmonaire dans le dossier et qu’elle est normale.
Il
y a un an, une femme de 64 ans est adressée en consultation pour une gêne
respiratoire. Elle a fumé et a des antécédents de dépression.
-
Depuis
avril, elle est un peu fatiguée et elle a une gêne respiratoire avec toux
persistante, quelques petits filets de sang et de temps en temps une
respiration sifflante. Elle a été mise sous corticoïdes inhalés.
-
En
juillet, elle est fatiguée et le traitement antidépresseur est repris.
-
En août
elle voit un collègue qui ne la trouve pas trop mal cliniquement et jugeant
que l’Athymil™ ne fait pas beaucoup d’effet, il demande quelques
examens : NFS et iono qui sont normaux. Il la rassure. Elle part en
vacances avec des corticoïdes par voie générale que lui prescrit un médecin
et qui entraîne une certaine amélioration.
-
Ce
n’est que trois mois après le début des troubles que cette femme a une
radio qui décèle une image parahilaire droite que précise le scanner. Elle
avait une tumeur de la bronche lobaire inférieure droite énorme.
-
Décès 3
mois plus tard.
Il
faut savoir que 3 mois de retard dans le diagnostic peuvent être grave en
matière de cancer. Tous les cancers n’ont pas un temps de doublement très
rapide, certains mettent 1 ou 2 ans pour prendre un cm. Il y en a d’autres
qui flambent et en trois mois sont condamnés.
3° cas
Une
femme de 36 ans est adressée par un centre de rééducation neurologique.
Elle a fait un incident respiratoire nécessitant une ventilation et suivi
d’un incident de réanimation avec déficit neurologique brachio-facial. En
fait cette complication est survenue après 12 jours d’intubation et de
ventilation pour asthme. En étudiant ce qui se passait depuis trois mois,
on apprenait qu’elle avait une dyspnée sifflante pour laquelle elle prenait
de la Ventoline® de façon importante. Deux mois auparavant, la gêne était
quotidienne et permanente ; elle prenait une bouffée par jour de
béclométasone. Depuis quinze jours, n’ayant plus de nuits tranquilles, il
avait été rajouté du Sérévent®.
Au
total, pendant trois mois, non seulement elle n’a pas eu le bon traitement
de fond (corticoïdes inhalés) et deuxièmement à aucun moment quelqu’un a
fait le diagnostic d’asthme instable qui a décompensé. Si elle avait eu 40
mg de Cortancyl® ou Solupred® pendant 5 à 7 jours (= dose moyenne de
corticoïdes), elle n’aurait pas fait d’accident.
4.2. Enseignements
Ces
cas cliniques permettent de rappeler que, avant de porter le diagnostic
d’asthme :
1
- La radiographie est indispensable, pour vérifier que l’image thoracique
soit normale.
2
- Les EFR sont nécessaires dans le bilan initial pour évaluer les fonctions
respiratoires de base.
4.3. Le Peak Flow
C’est
le débit expiratoire de pointe (DEP) ; il est très différent du VEMS.
Les
pneumologues ne s’intéressent qu’au VEMS (volume expiratoire maximum par
seconde), parce que c’est le paramètre qui en dit le plus et qui est le
plus reproductible. Quand le VEMS est normal c’est qu’il n’y a aucune
anomalie (asthme ou autres anomalies thoraciques réduisant la ventilation).
Le
Peak flow donne un résultat corrélé au VEMS et en règle une très bonne
appréciation.
Si
l’on enregistre à l’aide d’un pneumotacographe la courbe des débits expiratoires instantanés, on
obtient les courbes ci-jointes :
Sujet
normal (----)
Sujet
asthmatique (- - - )
Le
Peak Flow correspond à la crête de la courbe. Il se situe au 1/3 de l’expiration.
La
valeur théorique du Peak flow varie en fonction du sexe, de la taille et de
l’âge. Il existe des abaques en fonction de l’âge et du sexe..
-
Chez
les hommes : 500 à 600 l/min
-
Chez
les femmes : 450 l/min.
Attention, comme seuil de gravité, il ne faut
pas retenir 150 l/min, valeur qui est trop souvent prise en compte en
urgence, car chez des personnes jeunes il se situe à un niveau plus élevé
(exemple : 200 l/min. traduit un asthme sévère chez un homme de 30
ans).
L’intérêt
pour le praticien d’avoir un appareil de mesure du Peak Flow dans sa
sacoche est de pouvoir vérifier lors de la consultation ou en visite que
les troubles fonctionnels ressentis par le patient soient en concordance
avec le DEP pour éviter le piège de la sous-évaluation
5. LES STADES DE SEVERITE
Les
experts ont défini quatre stades de sévérité car le traitement de fond est
différent suivant le stade auquel se trouve un asthmatique :
L’asthme intermittent tel qu’il se définit dans le tableau
n’est pas suffisamment actif pour justifier un traitement de fond
quotidien, car il a peu de chance d’aller vraiment mal rapidement. Il n’y a
pas ou peu d’inflammation.
Les asthmes persistants se divisent en trois classes qu’il
faut bien connaître
|
Asthme
Intermittent
|
Gêne respiratoire < 1 fois/semaine
Fonction respiratoire normale (Peak
Flow)
Asymptomatique entre les exacerbations
Brèves exacerbations
Symptômes nocturnes ≤ 2
fois/mois
|
Ne nécessite pas de traitement de fond
|
|
Asthme
persistant léger
|
Gêne > 1 fois/semaine, mais < 1
fois/jour
Peak Flow normal
Exacerbations pouvant limiter l’action
et sommeil
Symptômes nocturnes > 2 fois /mois
|
Traitement de fond par corticoïdes
inhalés à faible dose
|
|
Asthme
persistant modéré
|
Symptômes quotidiens
Peak Flow abaissé > à 60 % de la
val. théorique
Exacerbations pouvant limiter l’action
et sommeil
Symptômes nocturnes > 1 fois
/semaine
|
Le traitement de fond doit être
entrepris rapidement = fortes doses de corticoïdes inhalés
+ utilisation quotidienne de ß 2
mimétiques LA
|
|
Asthme
persistant sévère
|
Gêne permanente au moindre effort
Fonction respiratoire très diminuée
< 60% de la valeur théorique
|
Justifie parfois un traitement de
corticoïdes au long court et de discuter la mise en surveillance
hospitalière
|
La
perception des symptômes par les patients est très difficile à évaluer. Des
études de recherche sont actuellement orientées sur ce thème :
-
Une
étude comparative japonaise portant sur des sujets normaux, des sujets
asthmatiques n’ayant jamais fait de fortes crises d’asthme, et de sujets
jeunes asthmatiques ayant déjà été intubés et ventilés a montré que lors de
situation d’hypoxie les sujets ayant été déjà intubés et ventilés :
o
ne
ressentaient pas de la même manière que les 2 autres catégories,
o
chez
eux les mécanismes d’adaptation respiratoire ne se faisaient
qu’imparfaitement.
-
Une
équipe israélienne a fait une étude portant sur 120 jeunes asthmatiques,
suivis par des généralistes. La fréquence de la dyspnée a été mesurée, et
les sujets ont été classés en 2 groupes :
o
Ceux
qui ressentaient correctement l’obstruction bronchique
o
Ceux
qui ne la ressentaient pas. Dans le groupe des sujets qui ne ressentaient
pas leur dyspnée, la mortalité fut de 15 % en 2 ans, mortalité qui était
corrélée à une utilisation presque nulle de Ventoline®.
En
conclusion, il est important, mais délicat parfois, de classer le stade
auquel se trouve un asthmatique.
L’important
est de bien évaluer les symptômes et leur retentissement fonctionnel. En
France, on utilise sans doute trop le mot de crise. Il vaudrait mieux
parler de gêne respiratoire qui favorise plus le dialogue avec le patient
asthmatique.
6. LE TRAITEMENT DE L’ASTHME
6.1. Les objectifs du
traitement
Ils
sont d’arriver à ce que le patient ait :
-
Peu ou
pas de symptômes diurnes et nocturnes, (objectif difficile chez les sujets
âgés)
-
Des
crises d’asthme rares
-
Une
activité non limitée, y compris l’exercice
-
Un
recours réduit aux ß 2 mimétiques de courte action
-
Des EFR
normales ou subnormales.
-
Sans
avoir besoin de consultation en urgence
6.2. Stratégie du
traitement
6.2.1. Le traitement de
fond
Il
ne s’adresse qu’aux « asthmes persistants ». ils sont classés en
3 groupes de gravité.
-
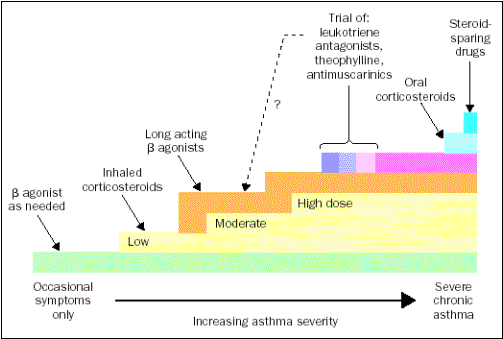
Les corticoïdes inhalés sont les seuls médicaments de fond à donner à tous les asthmes permanents que l’on peut augmenter en
fonction de la sévérité.
-
Les ß2 longue action sont des bronchodilatateurs de
référence à associer aux corticoïdes inhalés. Ils sont indiqués dans les
asthmes modérés et sévères, car il paraît excessif d’en donner à tous les
asthmes persistants.
-
Les antileucotriènes s’adressent aux asthmes persistants
légers à modérés et sont donnés avec
les corticoïdes inhalés.
-
Les corticoïdes par voie générale au
long cours trouvent
leur indication dans les formes sévères malgré un traitement inhalé.
6.2.2. Dans les
exacerbations sévères
Les
corticoïdes oraux sont prescrits à la dose de 40 mg/jour pendant 4 à 10
jours et peuvent être stoppés brutalement si l’asthme est contrôlé
Le
traitement symptomatique, essentiellement les ß 2 mimétiques de courte action,
n’est utilisé que lorsqu’il y a des symptômes
6.3. Définition du contrôle
de l’asthme
|
Le
contrôle optimal
|
Le
contrôle acceptable sous traitement de fond
|
|
-
Pas de
consommation de ß2 agoniste de courte action
-
L’absence
de symptôme diurne et nocturne
-
Une
activité normale
-
Des EFR
normales
|
-
Symptômes
diurnes ≤ à 2 fois/semaines
-
Une
consommation de ß2
-
Des EFR
normales ou subnormales
|
Une
remarque est à faire concernant l’évaluation de gravité des signes
présentés par un asthme persistant, signes qui permettent le classement en
asthme persistant léger ou modéré ou sévère. En effet on ne peut pas
évaluer de la même manière
-
Un
patient qui présente un asthme persistant alors qu’auparavant on pouvait le
classer comme asthme intermittent et qui ne prend pas de traitement de
fond. Dans ce cas, cela permet de dire que le sujet est rentré dans le
cadre d’un asthme persistant et qu’il faut entreprendre un traitement de
fond.
-
Un
patient qui était déjà sous traitement de fond, dans ce cas, il faut tenir
compte du traitement de fond pour évaluer le contrôle de l’asthme et
l’objectif n’est pas d’obtenir un contrôle optimal mais un contrôle
acceptable.
6.4. Les corticoïdes
inhalés
Les corticoïdes inhalés constituent
la base du traitement de l’asthme persistant.
Il
est classique en Europe de commencer par les corticoïdes inhalés. S’ils ne
suffisent pas, on va rajouter du Singulair™, des ß2 longue action.
6.4.1. Pourquoi les
corticoïdes ?
Les
corticoïdes sont les seuls médicaments à avoir un rôle simultané sur la
toux, la réduction des secrétions alvéolaires, la diminution de
l’inflammation, la diminution de l’action des médiateurs même s’il
n’agissent pas sur les leucotriènes, et ils ont un rôle majeur sur les
muscles bronchiques en potentialisant l’action des ß2.
La
conséquence de cela est que les corticoïdes inhalés sont les seuls
médicaments à pouvoir réduire la morbidité et la mortalité de cette
maladie.
La
Nouvelle-Zélande a la « palme » de la mortalité par asthme. Dans
ce pays, une étude de cette mortalité et morbidité au cours des 30
dernières années a montré une réduction progressive importante de la
morbi-mortalité depuis l’introduction des corticoïdes inhalés et de la
pénétration de leur emploi dans les habitudes médicales.
Il
faut commencer dans l’asthme persistant par les corticoïdes inhalés, il
faut savoir manipuler éventuellement les autres médicaments (ß2 longue
action « LABA » et antileucotriènes) mais toujours en association
des corticoïdes inhalés.
|
Traitement
|
Asthme
intermittent
|
Asthme
Persistant
|
|
 De fond De fond
|
Aucun
|
Léger
|
Modéré
|
Sévère
|
|
Corticoïdes
inhalés à doses croissantes en fonction du stade
|
|
|
ß 2
mimétiques à longue action (LABA)
|
|
+/-
Antileucotriène
|
Corticoïdes
oraux
|
|
De la crise
|
ß 2
mimétiques à courte action è à la
demande (SABA)
|
|
|
|
|
|
|
|
6.4.2. Les patients vont
prendre les corticoïdes inhalés pendant des années
Cela
pose le problème de leur tolérance. Jusqu’à présent on considérait que les
corticoïdes inhalés ne franchissaient que peu la barrière hématologique et
que le risque de conséquences générales était négligeable. Une étude
récente, parue dans le Lancet, remet en cause ce dogme tout au moins quand
on utilise des doses journalières autour de 1 000 µg :
Une
étude très bien conduite par Wong (GB) sur des asthmatiques de 20 à 40 ans
utilisant des corticoïdes inhalés et en éliminant ceux qui prenaient des
corticoïdes par voie orale. Ils ont mesuré la minéralisation osseuse avant
l’introduction des corticoïdes inhalés et après une dose cumulée moyenne de
prise pendant 6 ans avec une dose quotidienne autour de 1000 µg.
Ils
ont constaté que, après l’accumulation des doses de méclobétasone sur des
années, il y avait une petite
diminution de la densité osseuse, mais non suffisante pour dire qu’elle
soit pathologique. Mais cette constatation remet en cause l’inocuité
des corticoïdes inhalés.
A
partir de cette étude, les spécialistes considèrent qu’en cas de doses quotidiennes
≥ 1 000µg de façon régulière, il existe une indication à une
surveillance densitométrique à partir d’une dose cumulée de 5 000 µg En
effet 4 bouffées de 250µg / jour pendant 10 ans correspondent déjà à une
dose cumulée de 3500 µg de corticoïdes inhalés.
Certains
asthmatiques ne peuvent diminuer leur dose quotidienne au dessous de 500 ou
750 µg sans voir réapparaître leurs symptômes au bout de quelques jours à
semaines ; les conséquences osseuses à 15 ou 20 ans ne peuvent être
négligées, surtout s’ils sont jeunes (la dose cumulée se trouve à un même
ordre de grandeur que dans le calcul ci-dessus). Aussi certains
spécialistes commencent à suggérer d’abaisser la barre de l’indication à
une surveillance par densitométrie chez les sujets qui prennent une dose
quotidienne ≥ 500 µg de façon régulière (sans que l’on puisse la
réduire).
6.5. Le problème de la
compliance aux corticoïdes inhalés
Il est toujours difficile à évaluer. Une étude a été faite concernant la
compliance des asthmes persistants vis-à-vis des produits inhalés. Il était
demandé aux patients de noter sur un cahier tous les matins et/ou soirs
chaque prise de ß2 agoniste courte action durant les 24 h et cela pendant
15 jours. Le produit leur était fourni, identique au produit habituel, mais
le flacon nébuliseur possédant une puce invisible a permis de récupérer
l’heure et la date de chacune des bouffées effectuées.
Sur
le carnet individuel, le patient pour chaque jour a marqué toutes les
bouffées qu’il « dit » avoir prises dans les 24 h, chaque bouffée
étant signalée par un signe jaune et l’heure approximative. Travail très
contraignant
Sur
ce cahier après l’avoir récupéré ainsi que le nébuliseur, il est reporté, à
partir des renseignements donnés par la puce et avec une autre couleur,
chaque bouffée réellement effectuée en tenant compte des heures et en
vis-à-vis des données fournies par le patient.
Au
regard de beaucoup de ces cahiers, la non concordance des 2 courbes est
apparue évidente, non concordance portant sur :
§
Le
nombre de bouffées : celui des bouffées réellement effectuées très
inférieur à celui relaté par le patient
§
Les
heures des prises
7. Conclusions
§
L’asthme
est une maladie chronique des bronches.
§
Nécessité
d’une radiographie et d’EFR dans le bilan initial.
§
Classer
le stade de sévérité pour adapter le traitement de fond.
§
Evaluer
à chaque consultation le contrôle de l’asthme et mesurer le DEP.
§
Les
corticoïdes inhalés représentent la base du traitement de fond à tous les
stades de la maladie.

|