|
EPU95 – Montmorency
Neurologie
 Mise à jour du 24 Avril 2007 Mise à jour du 24 Avril 2007 

Syndrome des jambes sans repos & Syndrome d’apnée
obstructif du sommeil
A
partir d’un exposé du Docteur M.F.Vecchierini
(Neuropsychiatre – Explorations
Fonctionnelles - Hôpital Bichat – Paris)
Séance du 9 novembre 2006
1. Syndrome
des jambes sans repos
1.1. Introduction
La première
description du syndrome des jambes sans repos (SJSR) est probablement celle
de Thomas Willis en 1672, qui constitue l’une des plus anciennes
observations de l’histoire de la médecine du sommeil. Ce n’est qu’en 1945,
suite aux travaux d’Ekbom, que la maladie deviendra une entité
différenciée, nommée « Restless Legs Syndrome » ou Syndrome des
Jambes Sans Repos.
Ce n’est que ces
dernières années que différents travaux ont permis l’adoption de critères
diagnostiques précis permettant une meilleure connaissance de son
épidémiologie et de sa physiopathologie.
Malgré sa
description détaillée, le SJSR est resté méconnu et est vraisemblablement
sous diagnostiquée. Ainsi, même lorsque les symptômes sont relativement
handicapants, souvent les personnes atteintes ne consultent pas, ou voient
leurs symptômes attribués à tort à la nervosité, au stress, à l’insomnie,
aux problèmes vasculaires périphériques ou articulaires ou aux conséquences
du vieillissement.
Finalement, le
SJSR a été reconnu comme une affection neurologique.
Affection neurologique d’abord jugée d’origine périphérique puis centrale.
Il est logique de penser, qu’à terme, une approche globale, afférences
périphériques aberrantes déclenchant un générateur central pourra être
démontrée.
1.2. Les critères diagnostiques
1.2.1. Signes cardinaux (IRLSSG
International RLS Group)
4
Des besoin impérieux (compulsion) de bouger les
jambes, souvent associé à des sensations inconfortables et désagréables
(souvent difficiles à décrire par les malades...), touchant, parfois les
membres supérieurs.
4
Les symptômes apparaissent ou s’aggravent lors des
périodes d’inactivité ou de repos (position allongée ou assise).
4
Les symptômes sont totalement ou partiellement
soulagés par les mouvements, tels la marche ou l’étirement, tant que dure
l’activité.
4
Les symptômes apparaissent ou s’aggravent nettement
le soir ou la nuit.
1.2.2. Critères cliniques
additionnels
4
Une histoire familiale de SJSR.
4
Des troubles du sommeil
4
La présence de mouvements périodiques des jambes
(MPJ) (sommeil ou éveil).
4
Un examen neurologique normal, dans les formes
primaires.
4
Une évolution clinique variable : début à
n’importe quel âge, rémissions possibles, en général, évolution chronique.
4
Une réponse au traitement dopaminergique.
1.2.3. Diagnostic positif et de
sévérité
Le syndrome des jambes sans repos
est une maladie neurologique dont le diagnostic est clinique.
Le diagnostic
positif est facile dans les cas typiques (75% des cas pour le spécialiste).
Il est très
important de toujours évaluer la sévérité du syndrome et de confronter le
score de sévérité avec la plainte du sujet. C’est de cette confrontation
que découlera l’attitude thérapeutique.
Comment évaluer la sévérité
L’échelle de
sévérité internationale à 10 items (IRLSSG) avec cotation de 1 à 4 (Sleep
Medicine, 2003;4:121-2 ou http://www.mapi-research-inst.com), définit 4 niveaux de sévérité :
4
Score de 1 à 10 è
forme légère
4
Score de 11 à 20 è forme modérée.
4
Score de 21 à 30 è
forme Sévère.
4
Score de 31 à 40 è
forme très sévère.
|
Questionnaire
de sévérité du SJSR (IRLSSG)
|
|
A. Comment
évaluez-vous la gêne due aux impatiences dans vos bras ou dans vos jambes
?
0 1 2 3 4
B. Comment
évaluez-vous globalement le besoin de bouger dû aux impatiences ?
0 1 2 3 4
C.
Globalement, quel soulagement de la gêne dans les bras ou dans les jambes
obtenez-vous en bougeant ?
0 = Pas d’impatiences des membres, question sans objet.
1 = Soulagement complet ou presque complet
2 = Soulagement modéré
3 = Soulagement léger
4 = Pas de soulagement
D.
Globalement, quelle est la sévérité de votre trouble du sommeil dû aux
impatiences ?
0 1 2 3 4
E.
Globalement, quelle est la sévérité de votre fatigue ou de votre
somnolence ?
0 1 2 3 4
F.
Globalement, quelle est la sévérité de vos impatiences dans leur ensemble
?
0 1 2 3 4
G. À quelle
fréquence avez-vous des symptômes d’impatiences des membres inférieurs ?
0 = Aucune
1 = Légère (1 jour par semaine ou moins de 1 jour)
2 = Modérée (2-3 jours par semaine)
3 = Sévère (4-5 jours par semaine)
4 = Très sévère (6-7 jours par semaine)
H. Quand vous
avez des symptômes d’impatiences, quelle est leur durée en moyenne ?
0 = Aucune.
1 = Légère (moins d’une heure par jour)
2 = Modéré (1 à 3 heures par jour)
3 = Sévère (3 à 8 heures par jour)
4 = Très sévère (8 heures par jour ou plus)
I. Quel est
l’impact des symptômes d’impatiences sur votre capacité à mener votre vie
quotidienne, par exemple avoir une vie satisfaisante en famille, à la
maison, en société ou au travail ?
0 1 2 3 4
J. Quelle est
la sévérité de vos troubles de l’humeur dus à vos impatiences, par
exemple en colère, déprimé, triste, anxieux, ou irritable ?
0 1 2 3 4
|
L’échelle de
sévérité du groupe de Johns Hopkins (Allen et al, 2001), définit 3 stades
de sévérité selon l’heure d’apparition des symptômes.
4
Minime : Signes cliniques au coucher ou la
nuit
4
Modérée : Signes cliniques à partir de 18H.
4
Sévère : Signes cliniques avant 18H ou au
cours de la journée.
1.3. Epidémiologie
1.3.1. Prévalence élevée
Elle estimée à 6% (IC = 2 à 15%) de la
population générale.
Etude
internationale REST (Allen et al, Arch Intern Med, 2005)
4
La prévalence est de 7,2% en population générale.
4
Les formes sévères sont présentes chez 2,8% des
patients.
Etude française
INSTANT (Tison et al, Neurology 2005)
4
L’incidence augmente avec l’âge
4
La prévalence est de 8,5% en population générale,
dont 4,4% de formes très sévères.
4
La prévalence est plus importante chez les femmes
(sex-ratio=2/1) quelque soit l’âge.
4
La prévalence augmente avec l’âge. L’âge moyen de
début est de 48 ans.
4
Pas de variation géographique.
4
Une histoire familiale est retrouvée chez 41% des
malades.
1.3.2. Facteurs favorisants
4
La consommation de café, de thé, d’alcool;
4
La dépense physique intense surtout en fin de
journée.
4
La chaleur pour certains malades qui évitent de
couvrir leurs pieds d’une couverture. Le SJSR peut être plus intense l’été.
4
Certains médicaments, notamment les antidépresseurs
tricycliques, les IRS, la venlafaxine, le lithium, les neuroleptiques mais
pas le bupropion.
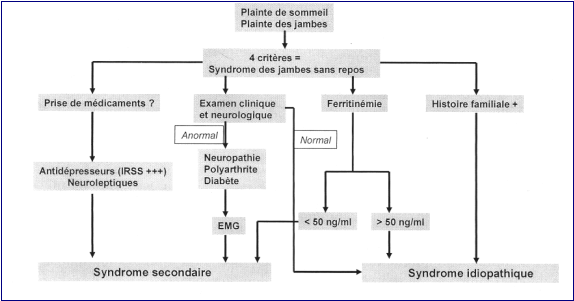
1.3.3. Etiologies
Quatre conditions
Elles sont
classiquement décrites comme responsables des formes secondaires de
SJSR :
4
Les carences ferriques, avec ou sans anémie, où la
sévérité des symptômes semble corrélée inversement au taux de ferritine
4
L’insuffisance rénale : 20 à 57 % des patients sous
hémodialyse. La transplantion rénale est suivie généralement d’une
amélioration substantielle, voire d’une disparition des symptômes dans les
3 semaines.32 La présence d’un SJSR est un facteur de mauvais pronostic
dans l’évolution de ces patients, avec une mortalité accrue dans les 2–5
ans
4
La grossesse, où la prévalence de symptômes liés au
SJSR atteint 19 %, avec 7 % développant des formes sévères, et 96 % de
résolution dans les 4 semaines qui suivent l’accouchement
4
La présence d’une polyneuropathie comportant, en
général une atteinte axonale, parfois infraclinique.
L’arbre
décisionnel proposé par Arnuff dans la lettre du Neurologue (2005) est
repoduit ci-dessous.
Le SJSR et les MPJS ont été
retrouvés associés à un grand nombre de maladies, présentées dans le
tableau ci-dessous.
Autres pathologies associées au
SJSR
·
Les syndromes d’apnées du sommeil +++
·
Les troubles du comportement en sommeil paradoxal
(REM sleep behavior disorder), la narcolepsie
·
Médicamenteuses : neuroleptiques,
antidépresseurs (tricycliques, SSRI, mirtazapine), lithium et séquelles de
rachianesthésie
·
Neurologique : maladie de Parkinson
idiopathique, atrophie multisystématisée, dystonie sensible à L-Dopa Ataxie
spinocérébelleuse, chorée de Huntington
·
Psychiatrique : syndrome d’hyperactivité avec
trouble de l’attention, syndrome de stress post-traumatique, dépression
·
BPCO, leucémie, polyarthrite rhumatoïde,
1.4. Diagnostic différentiel
Il n ’y a
pas réellement de diagnostic différentiel du SJSR mais il y a des erreurs
par défaut et par excès. Les 2 signes d’appel principaux de la maladie
sont :
·
Les troubles du sommeil, insomnie d’endormissement
et/ou éveils nocturnes prolongés
·
Les troubles sensitifs des membres inférieurs à
type de douleurs très mal décrits habituellement par les patients.
Devant les
troubles du sommeil, il faut rechercher :
·
Un syndrome anxieux parfois associé au SJSR cause
fréquente d’insomnie d’endormissement.
·
Un trouble obsessionnel-compulsif (rituels du
coucher, ruminations nocturnes…).
·
Des troubles de l’hygiène du sommeil (TV, travail…)
mais parfois engendrés par un SJSR.
Devant les
douleurs des membres inférieurs :
·
Troubles d’origine vasculaire : artérite ou
insuffisance veineuse+++
·
Douleurs neuropathiques mais les 2 pathologies
peuvent être associées et difficulté du diagnostic des neuropathies à
petites fibres (test à l’Emla, thermotest) +++
·
L’akathisie des neuroleptiques.
·
“Painful
legs and moving toes”,
·
Les crampes nocturnes.
1.5. Physiopathologie
1.5.1. SJSR et structures
nerveuses
Il a été
récemment montré que le système nociceptif était impliqué dans la
physiopathologie du SJSR. Les malades présentent une hyperalgésie mécanique
profonde aux stimuli cutanés et piqûres. Cette hyperalgésie est améliorée
par la L-DOPA
Ces résultats
suggèrent que le SJSR peut être associé à une sensibilisation centrale des
neurones spinaux, semblable à celle observée dans les douleurs
neuropathiques, qui met en jeu le système dopaminergique supraspinal.
Ces résultats
confirment que le SJSR est d’abord un trouble sensitif. Ces résultats
expliquent pourquoi des traitements efficaces dans les douleurs
neuropathiques, tels les opiacés et les anti- convulsivants, le sont aussi dans
le SJSR.
1.5.2. Dysrégulation du système
dopaminergique
Les études en
PET et en SPECT indiquent qu’il existerait un dysfonctionnement
post-synaptique D2 dans le striatum : baisse du nombre des récepteurs
ou de leur affinité pour le ligand. Les études en IRM et TEP confirment
l’absence du système nigrostrié et plaident pour l’existence de générateurs
sous-corticaux: activation du cervelet dans les zones riches en récepteurs
opioïdes µ et du thalamus controlatéral lors des symptômes.
L’efficacité des
agonistes dopaminergiques et, à l’inverse, aggravation du SJSR sous
antagonistes des récepteurs dopaminergiques sont des arguments en faveur
d’une diminution de la transmission dopaminergique dans le SJSR.
1.5.3. Dysrégulation du système
opioïdes
A doses
antalgiques, les opioïdes sont efficaces dans le SJSR.
Cet effet
s’exercerait par le système dopaminergique. Une étude in vitro a montré que
les opioïdes empêchaient l ’apoptose des cellules dopaminergiques de
la substance noire induite par le déficit en fer.
Ces résultats
font penser qu’un système opioïde intact est indispensable pour empêcher
l’expression clinique du SJSR.
1.5.4. Dysrégulation du
métabolisme du fer
Un déficit en
fer est commun à plusieurs formes de SJSR secondaires (I.R., anémie
férriprive, grossesse).
L’analyse du LCR
montre une baisse du taux de la ferritine et une élévation du taux de la
transferrine chez tous les patients atteints de SJSR.
La ferritinémie
(mauvais reflet du taux de la ferritine dans le SNC) est cependant corrélée
au taux du LCR et est aussi souvent diminuée chez les patients atteints de
SJSR.
Le sidérémie et
le taux d’érythropoïétine diminuent le SJSR des malades en I.R. terminale.
Les autopsies
des malades atteints de SJSR mettent en évidence une baisse du fer et de la
ferritine dans les neurones dopaminergiques de la substance noire. Ce
déficit en fer est lié à un défaut d’acquisition du fer par les cellules
dopaminergiques. Il provoquerait une diminution de l’expression des
molécules Thy1 engendrant un manque de stabilité des synapses
dopaminergiques.
L ’IRM
montre une diminution de la concentration du fer dans le locus niger et le
putamen dans le SJSR. Cette diminution est corrélée à l’intensité de la
symptomatologie.
1.6. Le traitement
1.6.1. Agonistes dopaminergiques
Efficacité
C’est le
traitement de choix actuellement.
La bromocriptine
(Parlodel™) (1,5 à 10 mg/j) et le pergolide (0,05 à 2 mg) sont des
agonistes dopaminergiques ergotés. Ils ont prouvé leur efficacité dans des
études contrôlées mais leur tolérance est modérée.
Le piribédil
(Trivastal™) pour des posologies de 25 à 350 mg/j a une efficacité
douteuse.
Le ropinirole
(Adartrel™) et le pramipexole (Sifrol™) sont des agonistes non ergotés des
récepteurs dopaminergiques « D2 » et « D3 » (AD). Le
ropirinole (Adartrel™) a démontré une activité sur :
4
L’amélioration du score de sévérité dès la 1ère
semaine et pendant 12 semaines
4
Une amélioration des paramètres subjectifs et
objectifs du sommeil des patients
4
Une diminution significative des MPJ. Ils ont
montré une amélioration des paramètres objectifs du sommeil
4
Aucun phénomène de rebond n’a été décrit.
La tolérance
Elle est
globalement bonne. Les effets secondaires les plus fréquemment rapportés
sont :
4
Des nausées
(30%), vomissements (10%),
4
De la
fatigue et des « étourdissements » (11%),
4
Des
céphalées (16%).
Ils sont peu
sévères et n’entraînent l’arrêt du traitement que chez moins de 10% des
sujets.
Le syndrome d’augmentation
C’est, sous
traitement, l’avancée d’horaire des symptômes. Les signes cliniques apparaissent
2H avant l’heure habituelle. Les symptômes peuvent atteindre les membres
supérieurs. Ce syndrome est très fréquent sous L-DOPA (50% en un an de
traitement), moins fréquent mais non chiffré sous agoniste dopaminergique.
Que faire ?
1. Contrôler la
ferritinémie.
2. Ajouter une
dose d’agoniste dopaminergique vers 17 heures è attitude risquée.
3. Diminuer la
dose d’agoniste dopaminergique en monothérapie ou en bithérapie si c’est
insupportable pour le malade en ajoutant du Neurontin™ ou du tramadol.
4. Parfois arrêt
de tout agoniste dopa sous couvert d’opiacés et de Neurontin™.
Le ropinorole (Adartrel™) et le
pramipexole (Sifrol™
Ce sont, à ce
jour, les seuls agonistes dopaminergiques à avoir une AMM pour le
traitement des formes modérées et sévères du SJSR idiopathique de l’adulte.
Les produits
sont remboursés à 65% par la SS dans les formes très sévères du syndrome.
La prescription
initiale doit être réalisée par un neurologue ou par un médecin spécialiste
exerçant dans un centre du sommeil.
1.6.2. L’utilisation des
opiacés
Efficacité
Leur effet
thérapeutique sur les symptômes se retrouve déjà dans la description
princeps de Willis en 1672, qui traita un cas sévère avec du laudanum.
Relativement peu d’agents de cette famille ont été étudiés de manière
adéquate.
4
L’oxycodone (Eubine™) à la dose de 15 mg semble
plus efficace que le dextropropoxyphène (Antalvic™),
4
La dihydrocodéine et la méthadone, opioïdes oraux à
longue durée d’action, peuvent être envisagés dans les formes sévères.
Tolérance
Les effets
secondaires fréquents sont à type de constipation, de majoration d’un
syndrome d’apnée du sommeil préexistant
Enfin, le risque
de dépendance existe.
1.6.3. Autres approches
thérapeutiques
Benzodiazépines
Le clonazépam
(Rivotril™) demeure le plus utilisé et le plus étudié. Il est actif à des
doses entre 0,5 et 2 mg le soir. Il est indiqué en cas de persistance de
troubles du sommeil. Il améliore les paramètres du sommeil.
Le triazolam
(Halcion™) améliore l’efficacité du sommeil chez ces patients et diminue
les éveils associés aux MPJ, sans pour autant diminuer le nombre de
ceux-ci.
Le diazépam
(Valium™) ne semble pas efficace pour traiter ces affections.
Les problèmes
liés aux benzodiazépines sont
4
Le risque de tolérance et d’accoutumance,
4
Le risque d’aggraver un syndrome d’apnée du sommeil
associé
4
Les effets résiduels diurnes, en particulier, la
somnolence.
Antiépileptiques
La carbamazépine
(Tegretol™) (200 à 1200 mg) est efficace sur les symptômes du SJSR mais pas
sur les MPJ.
La gabapentine
(Neurontin™) (600 à 2400 mg) est également efficace pour le traitement du
SJSR et pour réduire le nombre de MPJ. Elle améliore la qualité du sommeil
et semble donc une bonne alternative aux agents dopaminergiques, quand
ceux-ci sont contre-indiqués ou mal tolérés. Ils peuvent leur être associés
dans les formes graves de la maladie.
Le traitement martial
Il corrige la
symptomatologie. Un traitement oral par le fer améliore le SJSR en cas
d ’hypoferritinémie (<50 mg/ml). Une injection de 1000mg de fer en
IV (Earley et al, 2005) s’est montrée efficace sur les symptômes du SJSR.
1.6.4. Qui et comment traiter ?
On ne traite que
les formes modérées à très sévères, en fonction du score de sévérité et de
la gêne du patient.
On traite de
façon ponctuelle ou en continue selon la plainte du patient.
On traite après
avoir recherché une étiologie et notamment de façon systématique une
carence martiale.
Le même
traitement est efficace sur le SJSR et les MPJ (Allen et al, 2004).
2. Mouvements
Périodiques des Jambes « MPJ »
2.1. Définition
Les MPJ étaient
autrefois connus sous le nom de « myoclonies nocturnes » ou
« maladie de Symond ». C’est Lugaresi qui va préciser la nature
périodique de ces mouvements et leur association au SJSR. Ce sont des
mouvements de jambes involontaires :
4
Secousse ou décharge qui fait bouger les jambes
toutes seules
4
Touchant une jambe ou les 2.
4
Réalisent une extension du gros orteil, une flexion
dorsale du pied, et plus rarement de la jambe et/ou de la cuisse.
Ces mouvements
sont :
4
Présents à n’importe quel stade de vigilance.
4
Périodiques : toutes les 15 à 40 sec (5 à 90
s)
o
Ils durent de 0,5 à 5 s
o
Il doit y avoir au moins 4 mouvements consécutifs.
4
Plus abondants et plus longs au cours du sommeil
lent léger (stade 2) et en début de nuit ou dans la veille.
On parle de
syndrome de MPJ quand leur nombre ou index >5/H de sommeil.
2.2. Diagnostic positif
Il se fait par
polysomnographie et EMG. Les électrodes de surface sont positionnées sur
les muscles jambiers antérieurs. L’EMG met en évidence l’activation du
muscle, soutenue ou en bouffées.
La méthode de
quantification la plus couramment utilisée est celle décrite par Coleman,
adoptée par « American Sleep Disorders Association ». Selon cette
méthode, seuls les mouvements ayant une durée de 0,5 à 5 secondes et
survenant par séries d’au moins 4 mouvements consécutifs, séparés par des
intervalles de 4 à 90 s, sont comptés.
2.3. Conséquences
Ces mouvements
peuvent entraîner des réveils ou des micro-éveils qui sont séparés entre eux par un
intervalle de temps de 0,5 sec. Les micro-éveils et les réveils participent
à l’asthénie et à la fatigue exprimée par les patients.
Le plus souvent
les malades, quelle que soit la pathologie, n’ont pas conscience des MPJ.
Ils n’en parlent pas spontanément, les ignorent. Les MPJ sont donc très
sous-estimés par l’interrogatoire. Quand les MPJ sont très intenses, les
malades peuvent en avoir conscience. Parfois, c’est le ou la conjoint(e)
qui les rapporte.
En revanche, les
malades en ont tout à fait conscience et s’en plaignent quand les MPJ
surviennent durant la veille, dans le SJSR, l
2.4. Association MPJ & SJSR
Dans le SJSR,
les mouvements de jambes peuvent être volontaires. Il s’agit des
mouvements effectués par les malades pour soulager les impatiences. Les
mouvements de jambes sont aussi involontaires et périodiques chez
70% des malades au cours du sommeil et parfois à l’éveil (test
d’immobilisation forcé ou suggéré peut être un test diagnostique).
Mouvements de jambes après les apnées, parfois périodiques mais pas
toujours.
|
SJSR
|
MPJ
|
|
·
Mouvements volontaires
·
Symptômes subjectifs
·
Diagnostic clinique (critères IRLSS)
·
80 % des SJSR ont des MPJS
|
·
Mouvements involontaires et périodiques
·
D=
polysomnographique (critères de Coleman/ASDA)
·
30% des patients avec MPJ ont un SJSR
|
Sur la base
d’une étude, portant sur 131 patients atteints de SJSR, 80% avaient des MPJ
la première nuit d’enregistrement polysomnographique (seuil diagnostique
placé à 5 mouvements/heure de sommeil) et 7,6 % supplémentaires la deuxième
nuit.
Malgré cette
très forte association, tous les patients atteints de SJSR ne présentent
pas de MPJ, et à l’inverse, on peut trouver des MPJ de façon isolée, sans
évidence clinique de SJSR.
2.5. Traitement des MPJ isolés
2.5.1. Contexte
Il y a très peu
d’études contrôlées publiées sur traitement des MPJ isolés. Des résultats
anecdotiques ont été rapportés avec la mélatonine, le clonazepam
(Rivotril™), les opioïdes, le magnésium ou la dépakine (Depakot™).
Une étude
contrôlée (Saletu et al, 2001) a montré l’intérêt du ropinirole (Adartrel™)
sur la diminution des MPJ et des plaintes au réveil.
2.5.2. Recommandations
Actuellement,
pas de rationnel pour le traitement d’un syndrome de MPJ isolé (Hornyack et
al, Sleep Med reviews, 2006).
Les agonistes
dopaminergiques pourraient représenter une thérapeutique possible.
3. Syndrôme
d’apnée obstructive du sommeil « SAOS »
3.1. Introduction
C’est un trouble
respiratoire apparaissant durant le sommeil associé à des troubles durant
l’éveil à type de somnolence excessive.
Dans la forme
typique, c’est un homme de 50 ans ou plus, ayant un excès pondéral, avec un
cou court et épais, ronfleur, fatigué et/ou somnolent dans la journée. Ce
tableau typique est retrouvé dans 40 à 50% des cas.
Dans les autres
cas, un homme sans excès de poids, sans facteur de risques ou une femme
plus souvent après la ménopause.
3.2. Facteurs de risque
4
Morphologie du sujet : rétrognatisme, cou
court,
4
D’obstruction des VAS : volumineuses
amygdales, luette longue et flaccide…
4
Obésité (cou+++), alcoolisme, tabagisme, prise de
médicaments myorelaxants, benzodiazépines, notamment,
4
Histoire familiale, amygdalectomie
.
|
Facteurs
de risque
|
|
Facteur
|
Importance
|
Mécanisme
|
|
Sexe masculin
Age
Obésité
Ménopause
Alcool
Tabagisme
|
++
++
+++
+
++
+
|
Morphologie, contrôle ventilatoire
Diminution des boucles réflexes
Morphologie, stabilité du contrôle
respiratoire
Morphologie ??
Atteinte des muscles dilatateurs
Inflammation des VAD, oedème
|
3.3. Symptomatologie
3.3.1. Signes nocturnes
Le ronflement est-il ?
4
Intermittent, permanent, quotidien, ancien,
positionnel,…
4
Interrompu par des arrêts respiratoires avec des
reprises inspiratoires bruyantes (gasping) ? è Apnées
Le malade :
4
Se lève-t-il plusieurs fois la nuit pour
uriner ?
4
Est-il agité au cours du sommeil
4
Se réveille-t-il en sursaut ?
4
A-t-il des sueurs ?
3.3.2. Signes diurnes
Au réveil :
4
Sentiment de fatigue, inertie du sommeil,
difficultés à se réveiller.
4
Bouche sèche, sensation de mal de gorge, céphalée.
Dans la journée,
une somnolence diurne quantifiable qui est fréquemment
associée à :
4
Une diminution des performances au travail,
4
Une altération de la qualité de vie,
4
Une augmentation du risque d’accident..
3.3.3. Autres signes
Hypertension
Céphalées
nocturnes
Insuffisance
respiratoire
Difficultés
sexuelles (baisse de la libido).
Troubles de la
mémoire, difficultés d’attention et de concentration voire trouble de
l’humeur.
Il faut toujours
penser à rechercher un état dépressif, souvent associé au SAOS.
3.4. Critères diagnostiques
Il repose sur l’enregistrement
de la respiration au cours du sommeil :
Quantification
du ronflement, nombre et type des apnées et hypopnées, nombre des
limitations de débit donc sévérité du SAOS, retentissement sur la SaO2, le
rythme cardiaque
La mesure du
retentissement sur la vigilance de la journée peut se faire grâce à
plusieurs échelles :
4
L’échelle visuelle analogique,
4
L’échelle de Karolinska,
4
L’échelle de Standford
4
L’échelle d’Epworth, qui est un bon reflet des 6
derniers mois.
3.5. Mouvements des jambes et
retentissement sur le sommeil
3.5.1. Dans le SJSR
Les mouvements
de jambes peuvent être volontaires. Il s’agit, alors, de
mouvements effectués par le malade pour soulager les impatiences.
Les mouvements
de jambes sont aussi involontaires et périodiques chez 70% des
malades au cours du sommeil et parfois à l’éveil (test
d’immobilisation forcé ou suggéré peut être un test diagnostique).
3.5.2. Dans le SAOS
Les mouvements
de jambes apparaissent après les apnées et sont, parfois, périodiques mais
pas toujours.
|
SJSR
|
SAOS
|
|
Insomnie
d’endormissement
Sommeil
entrecoupé d’éveils
Sommeil non
réparateur et fatigue diurne.
|
Sommeil non
réparateur, fatigue, syndrome dépressif
|
|
Enregistrement
du sommeil è
MPJ dans 70% des cas du SJSR avec MPJ parfois
« micro-éveillant »
|
Les apnées
- Terminées
par une reprise respiratoire
- Associées à
des mouvements des jambes et corporels et des micro-éveils
|
3.6. Traitement du SAOS
3.6.1. Avec un MPJ non
respiratoires ou MPJ isolés
Traitement du
SAOS, puis enregistrement polysomnographique sous traitement du SAOS pour
juger de l’index des MPJ.
On peut se poser
la question de traiter les MPJ isolés suivants :
4
S’ils provoquent des micro-éveils
4
S’ils retentissent sur la qualité subjective et
objective du sommeil
4
S’ils affectent la vigilance du lendemain.
Traitement du
SAOS, puis enregistrement polysomnographique sous traitement pour juger de
l’index des MPJ.
3.6.2. Avec ou sans MPJ
respiratoires
Dans tous les
cas, règles hygièno-diététiques et arrêt des médicaments nuisibles.
4
Si ronflement et 5 > IAH < 15 è gestes ORL simples
(laser) ou UVPP traditionnelle ou en radiofréquence.
4
Si > 15 IAH < 30 è orthèse d’avancée
mandibulaire ou PPC si facteurs de risque cardio-vasculaire ou SDE
4
Si IAH>30 è
indication de PPC.
Dans tous les
cas, vérifier par une polysomnographie complète l’efficacité du traitement
sur les anomalies respiratoires, et vérifier la disparition des MPJ.
3.6.3. Avec ou sans SJSR avec
ou sans MPJ
Chaque entité
pathologique est traitée pour son propre compte. Il s’agit donc de l’association
de 2 approches thérapeutiques.
Il n’existe pas
de traitement spécifique des MPJ. Ils diminuent ou disparaissent sous
l’effet du traitement des pathologies causales. Il faut savoir que
Rodrigues et al (Sleep Medicine, 2006) ont rapporté une amélioration du
SJSR et des MPJ sous traitement isolé du SAOS. 1.7. Indications
thérapeutiques

|