Le début de la puberté : 4 Pour les filles, le 1er signe de puberté est le développement des seins. 4 Pour le garçon, on utilise la mesure du volume testiculaire (largeur > 25 mm, longueur > 35 mm). Il existe de grandes variations de l’âge du début pubertaire. Actuellement, il se discute de la nécessité de changer les critères de puberté avancée ou retardée. La question se pose particulièrement pour les filles. Deux grandes études multicentriques ont été menées aux USA en 1997 et 2003 : 4 L’étude de 1997 portant sur 17 077 filles dont 90 % blanches et 10 % d’afro-américaines a permis de constater que o 25% des petites afro-américaines normales o 8% des petites filles blanches avaient déjà des seins à 8 ans. 4 L’étude de 2003 portant sur 2510 filles a montré que o 10% d’entre elles avaient leurs règles avant 11 ans o 90% après 12 ans o les Afro-américaines avaient un développement plus précoce. En ce qui concerne les garçons, dans une autre étude américaine on constate que : 4 Les enfants Afro-américains ont un stade P2 plus précoce que les enfants blancs et hispaniques 4 Beaucoup d’enfants Afro-américains ont un début de développement testiculaire vers 9,5 ans 4 Et également de nombreux garçons blancs ont des signes pubertaires à 10 ans. 2. ENDOCRINOLOGIE DE LA PUBERTÉ
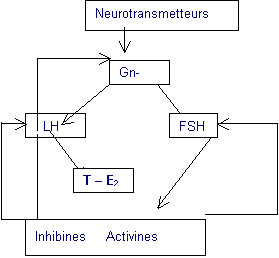
Hypothalamus Hypophyse Gonades 2.1. Le pourquoi et le comment du début de la puberté…Il este encore de nos jours un mystère de l’endocrinologie. Il est possible que de nombreux neuromédiateurs cérébraux jouent un rôle tous ensemble, alors que pris séparément leur action est minime. Il existe 3 niveaux dans le mécanisme de la régulation : 4 L’hypothalamus, 4 L’hypophyse, 4 Les gonades. La puberté commence avec une sécrétion pulsatile de GnRH hypothalamique qui stimule la sécrétion de LH et FSH hypophysaires. Ces dernières iront agir sur les gonades pour sécréter les œstrogènes chez la fille et la testostérone chez le garçon. Des facteurs de rétrocontrôle gonadiques (activines ou inhibines) activent ou freinent la sécrétion des gonadotrophines et de la GnRH en fonction du niveau de sécrétion des hormones sexuelles. 2.2. L’axe gonadotropeIl est activé entre 0 et 6 mois de vie. Chez les garçons une élévation de la testostérone (1-2 ng /ml) à un niveau identique à celle observée au début de la puberté. On ignore le rôle physiologique de cette activation gonadotrope, mais tous les garçons font un pic de sécrétion de testostérone et de gonadotrophines pendant cette période de la vie. L’axe gonadotrope se met ensuite complètement au repos jusqu’à ce que la puberté débute. Le début de la puberté est marqué sur le plan hormonal, par : 4 Une sécrétion pulsatile nocturne puis diurne de LH 4 Une augmentation des stéroïdes sexuels : œstradiol > 25 pg /ml, testostérone > 0,5 ng /ml 2.3. Sur un plan pratique….Il découle de cela un certains nombre de remarques pratiques : 4 Lors de la découverte d’une cryptorchidie, pendant cette courte période de 0 à 6 mois, le dosage de la testostérone permet d’avoir un reflet de la fonction testiculaire. Ce dosage est inutile si la cryptorchidie est explorée dans la petite enfance. 4 A partir de 2 ans et jusqu’à la puberté, en cas de suspicion d’anomalies de l’ovaire comme le syndrome de Turner chez la fille ou d’absence de testicules chez le garçon, Il est inutile, de doser la FSH et LH car, pendant cette période, les sécrétions de gonadotrophines sont basses. 4 Chez les filles, on n’utilise peu le dosage des œstrogènes car leur sécrétion est variable dans la journée et que leur dosage n’est pas suffisamment sensible. 4 Chez lez garçon, le taux de testostérone, à l’opposé, est un reflet fiable de la sécrétion testiculaire. Un taux supérieur à 0,5 ng/ml signe le début d’une puberté au niveau central. 3. PUBERTÉ PRÉCOCE3.1. La démarcheUne puberté précoce se définit : 4 Chez la fille par l’apparition des seins (1er signe pubertaire) avant 8 ans, 4 Chez le garçon par l’augmentation du volume testiculaire avant 10 ans. Elle impose une triple démarche La démarche diagnostique4 Est-on dans les critères cliniques d’âge ? 4 Est-ce vraiment une puberté précoce ? 4 Est-il d’origine centrale ou périphérique ?
L’évaluation du stade pubertaireElle s’effectue sur la clinique et les signes secondaires : 4 En le cotant, à partir de la classification de Tanner, et en notant l’évolutivité clinique 4 Sur l’accélération de la vitesse de croissance 4 Sur l’âge osseux à partir de la radio de la main gauche : l’apparition du sésamoïde signe le début de la puberté (11 ans chez la fille, 13 ans chez le garçon) 4 Le dosage de la testostérone chez le garçon 4 La mesure du corps utérin chez la fille par échographie pelvienne : o Une longueur > 35 mm (col exclu) est un signe de début de puberté. o Cet examen est très utile chez les petites filles de 1 à 4 ans amenées par leurs parents parce qu’elles ont des seins. o Il permet à lui seul de dire si la puberté a ou non débuté et de limiter les explorations. L’évaluation des conséquencesPour définir la taille cible de l’enfant, il faut se baser sur la taille de naissance, la taille des parents. On est parfois conduit à proposer un traitement pour améliorer le pronostic de taille si on se situe à un âge à la limite du pathologique : 4 Le médecin est inquiet pour la taille, car plus la puberté est précoce, plus la taille finale sera petite. 4 Les parents ne sont pas inquiets pour la taille, car leur enfant est en pleine poussée et qu’il ne dénote pas par rapport à ses camarades de même classe d’âge. Il s’agit d’un sujet très sensible car une taille acceptable pour les endocrinologues pédiatriques (1,50 m pour la fille et 1,65 m pour le garçon) est souvent inacceptable pour la famille qui consulte. Quel est le retentissement psychologique de la puberté sur l’enfant ?En hôpital de jour le bilan sera complété : 4 Test à la LH-RH et l’étude du pic de LH : la puberté est commencé si le pic LH > 5 ou si le pic LH > pic FSH 4 IRM cérébrale est à envisager 4 dosage de la hCG 4 Chez la fille, une échographie des ovaires ; chez le garçon, l’échographie des testicules est inutile car leur volume est évaluable à l’examen clinique. La 3ème démarche sera thérapeutique3.2. Les Pubertés Précoces CentralesLes pubertés précoces centrales sont plus fréquentes chez les filles (90 %) que chez les garçons (10 %). Classiquement, les pubertés précoces d’origine centrale sont : 4 Fréquentes et peu graves chez les filles 4 Rares chez les garçons qui présentent plus souvent une lésion organique.
On retrouve chez la fille non exceptionnellement des anomalies à l’IRM cérébrale, surtout devant un développement des seins avant 6 ans. Des lésions organiques du SNCElles doivent être recherchées par IRM dont les principales causes se trouvent dans le tableau suivant :
L’hamartome hypothalamiqueest une tumeur bénigne, peu évolutive, appendue à l’hypothalamus, associée souvent à des accès de rires immotivés (crises gélastiques qui sont des équivalents convulsifs), souvent passés inaperçus. Dans le passé, on a traité chirurgicalement ces tumeurs mais avec de grosses séquelles. La chirurgie de l’hypothalamus entraîne une dysrégulation de la température, de la pression artérielle et une augmentation de l’appétit incontrôlable. responsable d’obésités monstrueuses. Aujourd’hui, on ne fait plus appel à la neurochirurgie. Une surveillance (IRM) cérébrale annuelle ou bisannuelle s’impose. On ne sait pas pourquoi l’hamartome déclenche une puberté précoce. Le kyste arachnoïdien suprasellaireUn acte chirurgical possible est associé au traitement de la puberté précoce. Autres casDans l’hydrocéphalie, on traite la puberté précoce. Dans les tumeurs malignes responsables de puberté précoce, on initie le traitement de la puberté précoce, puis on débute la chimiothérapie ou la radiothérapie. Les formes idiopathiquesDans beaucoup de cas, aucune étiologie n’est retrouvée (puberté précoce centrale idiopathique). Interroger la mère sur l’âge de ses 1ères règles pour rechercher un facteur familial (études par analyse génétique sur les transmissions familiales de puberté précoce sont en cours). La puberté précoce chez les enfants adoptésUne puberté précoce est très souvent notée chez les enfants adoptés (surtout les filles) venant de pays du tiers monde. Des hypothèses sont soulevées pour en expliquer leur origine : 4 -Rôle de la renutrition chez des enfants dénutris à partir de signaux venant du tissu adipeux pour déclencher la puberté. Chez ces enfants malnutris qui ont un développement staturo-pondéral médiocre, une renutrition rapide entraîne une brusque augmentation de la masse adipeuse ce qui envoie un signal au niveau du SNC responsable du déclenchement de la puberté. D’autre part, il est nécessaire d’avoir un certain taux de masse grasse pour que la puberté se déclenche. Dans des études des années 1980, certains auteurs ont évalué qu’il était nécessaire d’avoir une masse grasse suffisante (environ 45 kg) pour déclencher la puberté. Ce qui expliquerait que les jeunes filles anorexiques ou que les athlètes féminines de haut niveau n’ont pas de règles. 4 Rôle des œstrogènes environnementaux ? L’environnement des pays occidentaux est saturé en œstrogènes. Par exemple le changement de sexe de certains poissons dans les lacs américains sous l’arrivée massive d’œstrogènes extérieurs ; beaucoup de femmes prennent la pilule, ce qui a une incidence sur le taux d’œstrogènes éliminés dans les eaux usées. Chez les enfants, il est possible que l’absorption passive d’œstrogènes joue un rôle dans les pubertés précoces, mais cela reste difficile à mettre en évidence. Dans les cas de puberté précoces chez les enfants adoptés, on traite comme dans les autres cas le mécanisme de la puberté, après avoir éliminé les causes organiques avec un bilan classique. Traitement des pubertés précoces centralesGénéraliésLes objectifs et indications du traitement freinateur de la puberté précoce chez les filles tiennent compte de divers paramètres : 4 De l’adolescente, gênée par leur nouvelle apparence 4 Des parents, inquiets de la survenue précoce des règles 4 Du médecin, inquiets pour la taille 4 Du degré d’évolutivité (cf tableau)
Les produits disponiblesLes médicaments actuels sont très efficaces, bien tolérés, sans grave effet secondaire, mais coûteux et plus ou moins douloureux. Il repose sur les analogues de la GnRH qui bloquent la synthèse de LH et de FSH en occupant les sites récepteurs de la GnRH. Ils doivent être prescrits en continu : 4 Triptoréline (Decapeptyl ®) utilisé par voie I.M. o 3 mg tous les 28 jours (AMM puberté précoce) o 11 mg tous les 90 jours (AMM pour l’adulte / étude pédiatrique en cours) 4 Leuproréline (Enanthone®), utilisé par voie S.C. o 3,75 mg tous les 28 jours (AMM puberté précoce) o 1,25 mg tous les 90 jours (AMM puberté précoce) Ces produits sont conditionnés sous forme de microbilles lipidiques d’où la nécessité d’injecter sans tarder le produit une fois reconstitué. Selon la tolérance la crème Emla ® peut être utilisée. Avec 4 injections par an (formes trimestrielles), ce traitement est devenu très acceptable pour l’enfant, mais le risque d’oubli est non négligeable avec une injection toutes les 12 à 13 semaines. Les points à surveiller pendant le traitement 4 Une prise de poids, surtout si une surcharge initiale existait 4 La tolérance aux injections qu’elles soient I.M. ou S.C. 4 La compliance ; son non respect justifie que les injections soient réalisées en hospitalisation de jour 4 Le retentissement psychologique 4 La vitesse de croissance, 4 L’âge osseux. 4 L’existence d’un déficit en hormone de croissance dans les formes neurogènes (gliome, irradiation) justifie l’adjonction de cette hormone au traitement. Les résultats du traitement freinateurIls sont bons : 4 Le ralentissement de la vitesse de croissance est obtenu en 6 mois ; une vitesse de croissance de 4 à 5 cm par an correspond à une croissance normale pour l’âge. 4 Les pics de LH et FSH chez la fille, le taux de testostérone chez le garçon reviennent à des valeurs prépubères. Les règles ne surviennent pas. Les seins chez la fille ne disparaissent pas, mais cessent de pousser. L’arrêt du traitementLe traitement est habituellement arrêté à l’âge où commence la puberté : 4 vers 11 ans chez la fille 4 vers 13 ans chez le garçon Poursuivre le traitement diminue l’amplitude de croissance finale. Toutefois l’âge optimal d’arrêt est encore controversé et devrait être évalué dans des essais prospectifs. Le bénéfice du traitement concerne la taille Chez des filles ayant présenté une puberté précoce, le bénéfice obtenu par la triptoréline sur la taille adulte a été comparé, à partir d’observations anciennes de puberté précoce (contrôles historiques), à la taille finale de filles, n’ayant pu bénéficier de ce type de traitement. (tableau ci-dessous)
Le traitement permet d’atteindre au moins la taille prédite. Mêmes constatations chez les garçons dans une étude similaire : la taille prédite est atteinte surtout chez ceux qui avaient une puberté très précoce avec un pronostic de taille catastrophique (1,40 m à 1,50 m). 3.3. Puberté précoce de cause périphériqueLe diagnosticLes pubertés précoces de cause périphériques sont beaucoup plus rares et sont difficiles à repérer cliniquement. Dans la plupart des cas, le diagnostic est fait sur : 4 L’absence d’activité de l’axe hypothalamo- hypophysaire au test à la GnRH mettant en évidence : 4 Des taux de FSH et LH effondrés (0,2 – 0,3) et sans pic alors que les taux d’œstradiol ou de testostérone sont très élevés 4 L’échographie pelvienne chez la fille, à la recherche d’une tumeur de l’ovaire. Trois exemples de puberté précoce de cause périphérique : 4 Le syndrome de Mac Cune-Albright 4 La tumeur de la granulosa chez une petite fille 4 La testotoxicose chez un petit garçon
Le syndrome de McCune-AlbrightIl fut décrit en 1960 4 Puberté précoce d’origine gonadique 4 Tâches café au lait en carte de géographie intéressant souvent un hémicorps (différentes de la neurofibromatose de Recklinghausen) La dysplasie fibreuse des os longs (fractures)Ces enfants sont porteurs d’une mutation activatrice de Gs alpha survenant tôt au cours de l’embryogénèse, affectant certains tissus en particulier la thyroïde, la peau et l’os. La prise en charge thérapeutique est compliquée : 4 Il est inutile de freiner la puberté puisque l’axe hypothalamo-hypohysaire est au repos 4 Le traitement repose sur les inhibiteurs de l’aromatase pour effondrer le taux d’œstradiol Si l’on ne traite pas, la puberté évolue par poussées avec pour conséquences : 4 des règles 4 une soudure précoce des cartilages. La Tumeur de la granulosaL’échographie pelvienne est un examen important chez la petite fille. Elle permet de ne pas passer à côté d’une tumeur ovarienne, dont le traitement est au moins chirurgical. Le tableau clinique est marqué par une évolutivité rapide des stades (S2 - P2 à S3-P3) avec une accélération de la vitesse de croissance, associée à des taux d’œstradiol et d’inhibines B très élevés. La testotoxicoseC’est une maladie liée à une mutation germinale activatrice du récepteur de la LH. Les enfants d’une même famille avec la même mutation ne font pas tous une puberté précoce. On ignore la cause du déclenchement de la puberté précoce avec un taux de testostérone très élevé et une LH et Gn-Rh basses. Il n’y a aucun signe clinique. 4. LES RETARDS PUBERTAIRES4.1. GénéralitésLe retard pubertaireIl est définit par : 4 L’absence de développement des seins chez une fille de 13 ans 4 L’absence d’augmentation du volume testiculaire chez un garçon de 15 ans La démarche diagnostique est identique à celle de la puberté précoce : 4 Affirmer le retard pubertaire. Il y a moins de discussions sur les limites d’âge, mais il n’est pas toujours évident de faire la différence entre : o Retard pubertaire : enfant qui a commencé sa puberté et qui l’arrête (par exemple une fille réglée une fois puis plus de règles) o Impubérisme : absence complète de puberté (fille de 15 ans et absence de développement des seins). 4 Déterminer l’origine centrale ou périphérique : o Origine centrale ou Hypogonadisme hypogonadotrope caractérisée pas l’absence de sécrétion de GnRH, de FSH et LH que l’on dépiste par le test LHRH avec gonadotrophines basses sans pic. o Origine périphérique traduisant une maladie de la gonade (ovaire, testicules). Les taux de FSH et de LH sont très élevés. Le diagnostic différentielLe retard simple de la croissance et de la puberté, chez le garçon, est très fréquemment rencontré : 4 Infléchissement de la courbe de vitesse de croissance pendant 1 ou 2 années vers 10 ans 4 Démarrage pubertaire tardif vers 14 – 15 ans. Chez ces enfants, consultants tôt du fait d’une inquiétude liée à la taille, il n’est pas facile de définir une stratégie. A quel moment déclencher un bilan d’exploration pour ne pas rater un diagnostic ? 4.2. Les hypogonadismes centrauxLe craniopharyngiomeC’est la tumeur cérébrale la plus fréquente en pédiatrie. En pratique, il faut déclencher un bilan le plus exhaustif avec avant tout une IRM cérébrale à la recherche d’un craniopharyngiome devant : 4 Une cassure de la courbe de croissance 4 L’absence de signes de puberté ou des signes de puberté tardifs avec des gonadotrophines basses Il existe un risque important de compression du chiasma optique (avec évolution rapide vers la cécité totale). L’intervention chirurgicale doit être le plus précoce possible, d’où un recours facile à l’IRM dans les cassures de croissance et les retards pubertaires pour dépister les petites tumeurs. La chirurgie doit épargner la région hypothalamique ce que permet l’aspiration trans-sphénoïdale, mais la crainte des neurochirurgiens est de ne pas enlever totalement la tumeur et de laisser des reliquats qui vont repousser. Sur ces reliquats, on a recours actuellement à la radiothérapie ciblée (la radiothérapie conventionnelle est abandonnée du fait des déficits cognitifs qu’elle induit surtout chez les enfants traités en bas âge). La principale complication en cas de destruction de l’hypophyse (compression tumorale, chirurgicale) est la survenue d’une obésité morbide par dérégulation du comportement alimentaire. En effet, les craniopharyngiomes opérés par voie haute, parce qu’il a fallu enlever la coque fibreuse haut placée, ont tous des courbes de poids qui s’envolent. En plus d’avoir un hypopituitarisme complet pour lequel les enfants vont devoir prendre un traitement, se développe une obésité monstrueusement importante. Après l’intervention neurochirurgicale, la croissance reprend de façon très correcte. C’est le choix du traitement qui va conditionner l’évolution. Les maladies génétiquesParmi celles responsables d’hypogonadisme hypogonadotrope, on dénombre de multiples syndromes par absence de GnRH. Il s’agit de maladies congénitales. L’enfant a déjà des signes cliniques à la naissance qui, parfois, passent inaperçus : 4 Une micropénis chez un enfant né à terme (verge < 2,5 cm) 4 Une cryptorchidie bilatérale Leur présence doit faire doser absolument la testostérone chez le nouveau-né ou le nourrisson de moins de 3 mois. 4 Si la testostérone est effondrée, il existe une très forte probabilité d’anomalies pubertaires, car normalement entre 0 et 6 mois le taux de testostérone chez le garçon est élevé (cf. § II). 4 Ainsi, entre 0 et 6 mois avec une simple prise de sang et une enquête généalogique, il est possible de bien orienter le diagnostic. En l’absence de dépistage précoce, il ne se passe rien pendant la petite enfance. C’est vers 15 – 18 ans qu’arrivent ces garçons parce que leur puberté n’a pas commencé ou ne se poursuit plus : 4 Leur développement et leur croissance ont été satisfaisantes car la production d’IGF1 est normale. Ils ont continué à grandir de 4 à 5 cm par an comme des enfants en phase prépubertaire. 4 Leurs organes génitaux ont l’aspect de ceux d’un enfant de 4 ans. Dans le syndrome de Kallmann, on retrouve parfois une agénésie rénale, des syncinésies d’imitation. Il existe deux gènes connus responsables de cet hypogonadisme central du garçon : 4 une forme liée à l’X (la mère transmet, et les garçons sont malades) 4 une forme autosomique dominante. Le retard pubertaire est lié à une absence de sécrétion de gonadotrophines. Il est associé à une hypo ou une anosmie. Ces 2 troubles sont dus à l’absence de migration (normalement concomitante) des neurones olfactifs et des neurones à la GnRH au cours de l’embryogénèse 4.3. Les retards pubertaires d’origine périphériqueLe syndrome de Turner,La plus fréquente des dysgénésies gonadique, le syndrome de Turner atteint 1/2000 filles, ce qui ne représente que la partie immergée de l’iceberg puisque la presque totalité des syndromes de Turner se terminent par une fausse couche précoce. Cliniquement on trouve : 4 Un retard de taille prononcé <- 2 DS 4 Une absence de signe pubertaire avec des dosages de FSH et LH de type ménopause, car les ovaires sont non fonctionnels. La plupart des syndromes de Turner devraient être dépistés devant un retard de taille <-2DS par un caryotype. 4 Seulement 30 % ne le sont que devant une absence de développement pubertaire. 4 Actuellement, le diagnostic anténatal est plus fréquent, lié à l’augmentation des amniocentèses réalisées dans le cadre du dépistage de la trisomie du fait de l’âge de la mère ; 4 La discussion d’une interruption thérapeutique de grossesse possible est difficile, car il s’agit d’une maladie compatible avec la vie, mais aussi extrêmement lourde pour ces enfants très médicalisés au cours de leur vie. Chez ces petites filles, les ovaires sont normaux jusqu’à 16-17 semaines de grossesse, puis se produit une accélération de l’apoptose avec une régression considérable du stock de follicules qui auront totalement disparu à la naissance. En l’absence de diagnostic précoce, il ne se passe rien jusqu’à la puberté puisque la FSH est normale, et il n’est pas possible actuellement de faire le diagnostic cliniquement. 4 C’est l’échographie pelvienne qui montre un utérus encore tout petit à 15 ou 16 ans et des bandelettes ovariennes à la place d’ovaires (les 2 chromosomes X sont nécessaires au développement ovarien) 4 Le caryotype confirmera le diagnostic : nombreux types sont possibles (45 X/46 XX, 45 X/ etc). 4 En cas de mosaïque avec présence du chromosome Y, il est nécessaire de pratiquer l’ablation des bandelettes ovariennes pour risque de survenue non exceptionnelle de tumeur. Dans le syndrome de Turner on peut retrouver d’autres signes cliniques : 4 Des signes osseux : cubitus valgus, ostéoporose 4 Des signes cutanés : nævus, mamelons écartés, implantation basse des cheveux, ptérygium coli 4 Des malformations cardiaques : coarctation de l’aorte 4 Des anomalies rénales : rein en fer à cheval 4 Des troubles du métabolisme lipidiques 4 une hypothyroïdie, un diabète ou une HTA, de façon plus fréquente que dans la population normale Ces jeunes filles, habituellement décrites avec un retard intellectuel, présentent, en fait, une surdité de transmission et de perception : 4 Nécessitant une surveillance ORL soutenue avec audiogrammes répétés, 4 Le traitement des otites, pose de yoyos, et appareillage auditif précoce. Si la surdité est bien prise en charge, le développement intellectuel est le plus souvent normal (sauf si une anomalie en anneau de l’X, qui est associée à un retard mental plus important). La coarctation de l’aorte est liée à une anomalie de la qualité du tissu élastique de la portion ascendante de l’aorte responsable d’une dilatation de cette portion et de décès par rupture de la crosse. Une surveillance échographique ou par IRM tous les 2 ans pour pouvoir procéder à la pose d’une prothèse en téflon dès que le diamètre de l’aorte atteint des valeurs critiques. L’induction de la puberté se fait avec un traitement œstroprogestatif assurant un développement pubertaire normal avec règles et cycles normaux. Mais, il s’agit d’une insuffisance ovarienne avec une fécondité nulle d’où la nécessité d’avoir recours au don d’ovocytes avec risque accru de grossesse à risque. Le recours à l’hormone de croissance est également nécessaire, car le pronostic de taille est mauvais (1,41 cm) ; il est entrepris dès que le diagnostic de Turner est posé (pendant une 15aine d’années si le diagnostic a été précoce) Dysgénésies gonadiques du garçonLa FSH et LH sont élevées Le syndrome de KlinefelterLe début de la puberté est sensiblement normal puis arrêt et pas d’augmentation du volume testiculaire. Les séquelles de chimiothérapie par cyclophosphamideLa réversion sexuelleIl s’agit d’un défaut de développement des gonades primitives, morphotype mâle avec phénotype féminin. Les anorchidiesLe garçon (XY) naît sans testicule et avec une verge de taille normale. Il n’y a pas d’utérus. 4 Normalement, on ne sort pas de la maternité si les testicules ne sont pas palpables. Jusqu’à preuve du contraire, un garçon qui n’a pas de testicules palpables, c’est une fille qui a un bloc 21. Pour les chirurgiens, il s’agit de torsion anténatale des testicules. 4 Le testicule fœtal fabrique l’hormone anti-mullérienne à partir de la 12-14ème semaines de grossesse, ce qui induit la régression de l’utérus. Il s’agit d’une anomalie survenue entre la 14-39ème semaine de grossesse. 4 Si le diagnostic est fait en période néo-natale, l’absence de tissu testiculaire peut être affirmée par o Des taux nuls de testostérone è reflet de l’absence d’activité des cellules de Leydig) o Des taux nuls de l’hormone anti-Mullérienne è reflet de l’absence de l’activité des cellules de Sertoli Sinon, on voit ces garçons parce que leur puberté ne se produit pas. On induit la puberté avec un traitement par testostérone. Ce sont des sujets infertiles et on pose des prothèses testiculaires à la puberté. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||